
【题目】如图是工业制取菱镁矿MgCO3(含杂质Al2O3、FeCO3)制取镁的工艺流程

请回答有关问题:
(1)菱镁矿进入酸浸池前需要粉碎,目的是 __________________________。
(2)氧化池通入Cl2的目的是氧化 _________________________(填化学式),工业上不选用硝酸做氧化剂的原因是_________________和_________________________。
(3)物质甲可以是_____________
A、MgO B、Mg(OH)2 C、NaOH溶液 D、稀氨水
(4)由MgCl2溶液制取无水MgCl2的操作方法 __________________________。
(5)当Fe3+完全沉淀时,求最小pH__________。已知:氢氧化铁ksp=1.0×10-38,离子浓度小于1×10-5 mol/L认为沉淀完全
【答案】 增大接触面积,加快溶解速率 FeCl2 引入杂质离子NO3- 产生污染性气体氮氧化物 AB 在干燥的HCl气流中加热蒸干 3
【解析】(1)酸浸前将菱镁矿粉碎,可以增大接触面积,加快溶解速率;
(2)为除去溶液中的Fe2+,氧化池通入Cl2的目的是氧化FeCl2,如果用硝酸替换氯气做氧化剂,则会引入杂质离子NO3-,同时产生污染性气体氮氧化物;
(3)物质甲是调节溶液pH,使溶液中Fe3+沉淀完全,根据除杂不引入新杂质的原则,可以选择MgO或Mg(OH)2 ,故答案为AB;
(4)因加热能促进Mg2+,由MgCl2溶液蒸发结晶制取无水MgCl2时需要在干燥的HCl气流中加热蒸干;
(5)ksp=c(Fe3+)×c3(OH-)=1.0×10-38,当Fe3+离子浓度小于1×10-5 mol/L认为沉淀完全,此时c(OH-)=1.0×10-11mol/L,pH=3。


科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A. 反应在前50 s的平均速率为v(PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol·L-1,则反应的△H<0
C. 相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D. 相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应:2NO2(g)![]() 2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
I | 0.6 | 0 | 0 | 0.2 |
II | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 达平衡时,容器I与容器Ⅱ中的总压强之比为 4∶5
B. 达平衡时,容器中Ⅱ中 c(O2)/ c(NO2) 比容器I中的大
C. 达平衡时,容器Ⅲ中NO的体积分数小于50%
D. 当温度改变为 T2时,若 k正=k逆,则 T2<T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2FeCl3+Cu=2FeCl2+CuCl2。
(1)请用双线桥法标出电子转移的方向和数目____________________。
(2)当有0.3 mol电子发生转移时,发生反应的Cu的质量为_____________。
(3)请将以上反应改写为离子方程式____________________。
(4)配平下列方程式:__FeCl2+___H2O2+___HC1=___FeCl3+___H2O。
(5)下列变化中,需要加入还原剂的是__________________
A.浓H2SO4→SO2 B.H2S→S C.HCO3-→CO2 D.Fe2+→Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=+489.0 kJ·mol-1 C(石墨)+CO2(g)=2CO(g) △H2=+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为____________。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H

①该反应的平衡常数表达式为K=__________。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图所示,则该反应的ΔH_____0(填“>”、“<”或“=”)。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>”、“<”或“=”)。

(3)以CO2为原料还可以合成多种物质,用硫酸溶液作电解质进行电解,CO2在电极上可转化为CH4,该电极应与电源 ___________(填“正极”、“负极”)相连,其电极反应的方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用乙酸和乙醇制备乙酸乙酯,为除去所得的乙酸乙酯中残留的乙酸,应选用的试剂是( )
A.饱和碳酸钠溶液B.饱和 NaOH溶液C.饱和食盐水D.浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯乙烯的结构为![]() 。有关该物质的下列说法正确的是
。有关该物质的下列说法正确的是
A. 该物质在一定条件下和氢气完全加成,加成产物的一溴取代物有6种
B. 该物质能使溴水和酸性高锰酸钾溶液褪色,褪色原理完全相同
C. 苯乙烯分子的所有原子不可能在同一平面上
D. 除去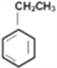 中的苯乙烯可以通入等量氢气反应
中的苯乙烯可以通入等量氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质属于电解质的是______;能导电的是_____;属于弱电解质的是______(均填写序号)。
①醋酸溶液②乙醇③胆矾④熔融氯化钠⑤二氧化硫⑥氨水⑦硫酸钡⑧蔗糖⑨氢氧化铁⑩浓盐酸
(2)Cl2通入一定浓度NaOH溶液后生成了三种含氯化合物,其中n(NaClO):n(NaClO3)= 5:1,写出Cl2与NaOH溶液反应的化学方程式并用双线桥表示出电子转移的方向和数目:_________。
(3)标准状况下4.48LCO2溶于100mL3.0mol/LNaOH溶液,所得产物成分是_____,物质的量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com