
【题目】人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用率,而且能够更好地保护环境,请回答下列问题:
(1)工业合成氨是制取氮肥的基础。合成氨反应中,反应物 N2 的结构式是_______________,产物NH3 的电子式是_________________。
(2)某小组在实验室模拟以 NH3 为原料, 制备少量硝态氮肥 Ca(NO3)2,转化途径如下(转化所需试剂及条件已略去)。
![]()
①NO→NO2 的现象是______________, NO2→HNO3 的化学方程式为____________________。
②将HNO3 转化为 Ca(NO3)2,列举两种不同类别的化合物 M___________________(写化学式) 。
(3)①NH4HCO3 是一种铵态氮肥,需阴凉处保存,原因是_______________(写化学方程式)。
②实验室检验某化肥是铵态氮肥,检验过程中发生反应的离子方程式为___________________。
(4)过渡施用氮肥将导致大气中NH3含量增高,加剧雾霾的形成。(NH4)2SO4是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去) 
①X可能是SO3 或_______________,Y是_____________。
②尿素CO(NH2)2是一种常用有机氮肥,缓慢与 H2O 发生非氧化还原反应释放出NH3和另外一种气体,该反应的化学方程式为________________。
【答案】N≡N ![]() 有红棕色气体产生 3NO2+H2O=2HNO3+NO CaCO3、Ca(OH)2 NH4HCO3
有红棕色气体产生 3NO2+H2O=2HNO3+NO CaCO3、Ca(OH)2 NH4HCO3![]() H2O+CO2↑+NH3↑ NH4++OH-
H2O+CO2↑+NH3↑ NH4++OH-![]() NH3↑+H2O H2SO3 H2SO4 CO(NH2)2+H2O=2NH3↑+CO2↑
NH3↑+H2O H2SO3 H2SO4 CO(NH2)2+H2O=2NH3↑+CO2↑
【解析】
(2)氨催化氧化得NO,NO和氧气反应生成NO2,NO2与H2O反应生成HNO3和NO,HNO3和CaCO3、Ca(OH)2等物质反应得Ca(NO3)2;
(4)含硫燃料燃烧产生SO2,SO2和水反应生成H2SO3,H2SO3被氧气氧化成H2SO4,H2SO4和氨气反应生成(NH4)2SO4;
或者含硫燃料燃烧产生SO2,SO2和O2反应生成SO3,SO3和H2O反应生成H2SO4,H2SO4和氨气反应生成(NH4)2SO4;
(1)N2的结构式为N≡N,NH3的电子式为![]() ,故答案为:N≡N;
,故答案为:N≡N;![]() ;
;
(2)①NO为无色气体,NO2为红棕色气体,所以NO→NO2 的现象是有红棕色气体产生,NO2和H2O反应生成HNO3和NO,所以NO2→HNO3的化学方程式为3NO2+H2O=2HNO3+NO,故答案为:有红棕色气体产生;3NO2+H2O=2HNO3+NO;
②HNO3和CaCO3、Ca(OH)2等物质反应均可转化为Ca(NO3)2,故答案为:CaCO3、Ca(OH)2;
(3)①NH4HCO3受热易分解,发生的反应为NH4HCO3![]() H2O+CO2↑+NH3↑,故答案为:NH4HCO3
H2O+CO2↑+NH3↑,故答案为:NH4HCO3![]() H2O+CO2↑+NH3↑;
H2O+CO2↑+NH3↑;
②铵态氮肥含NH4+,检验氨态氮肥即检验NH4+,检验NH4+的方法为:取待检氮肥溶液于试管中,加浓NaOH,加热,用湿润的红色石蕊试纸检验生成的气体,若试纸变蓝,证明有NH4+,该氮肥属于铵盐,涉及的反应的离子方程式为NH4++OH-![]() NH3↑+H2O,故答案为:NH4++OH-
NH3↑+H2O,故答案为:NH4++OH-![]() NH3↑+H2O;
NH3↑+H2O;
(4)①氨气和硫酸反应生成硫酸铵,Y为硫酸,亚硫酸被氧化成硫酸,或者三氧化硫与水反应生成硫酸,X为SO3或H2SO3,故答案为:H2SO3;H2SO4;
②由题意可知,CO(NH2)2和H


科目:高中化学 来源: 题型:
【题目】目前,处理锌矿进行综合利用,多采用传统的“高氧酸浸法”,但该法也存在一些缺点。最近,有文献报道:用高铁闪锌矿(含有ZnS、FeS、CuS、CdS及少量SiO2等)为原料,采用“高氧催化氧化氨浸法”可以联合制取Cu2O(红色)、CdS(黄色)、锌钡白(白色)三种颜料,其流程如图:
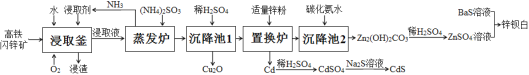
已知:
Ⅰ:浸取剂由碳酸铵、氨水、双氧水等组成;
Ⅱ:浸渣为S、Fe(OH)CO3、SiO2等不溶性物质;
Ⅲ:浸取液中含有[Zn(NH3)4]2+、[Cu(NH3)4]2+、[Cd(NH3)4]2+;
Ⅳ:Cu+在溶液中不存在,但可以与NH3形成稳定的[Cu(NH3)2]+。
回答下列问题:
(1)为加快浸取速度,可以采取的措施是(任答两项)_______;在实际生产中采取常温下浸取而不采用加热的方法,其原因是___。
(2)浸取釜中有O2参与生成浸渣Fe(OH)CO3的离子方程式为_______。
(3)蒸发炉中加入(NH4)2SO3的主要作用是_________;沉降池1中加入稀H2SO4的作用是_______。
(4)在制取ZnSO4和CdSO4时使用硫酸的量要适当,如果硫酸过量,产生的后果是______。
(5)无论采用“高氧酸浸法”还是“高氧催化氧化氨浸法”,其前期处理,都要经过用浸取剂浸取这一步,不同的是“高氧酸浸法”需先高温焙烧,然后再用硫酸浸出。两种方法比较,“高氧酸浸法”存在的缺点是(任答两条)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的![]() 元素,用元素符号或化学式填空回答以下问题:
元素,用元素符号或化学式填空回答以下问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 |
|
| ||||||
三 |
|
|
|
|
|
| ||
四 |
|
|
(1)化学性质最不活泼的元素原子的原子结构示意图为________;
(2)元素![]() 、
、![]() 的简单氢化物中的稳定性最强的是______________
的简单氢化物中的稳定性最强的是______________![]() 用化学式表示
用化学式表示![]() ;
;
(3)元素的最高价氧化物对应的水化物中酸性最强的是________,碱性最强的是_______,呈两性的氢氧化物是_______________,元素![]() 的最高价氧化物对应水化物中含有的化学键类型为________________;
的最高价氧化物对应水化物中含有的化学键类型为________________;
(4)在![]() 四种元素中,简单离子半径最小的是_________;
四种元素中,简单离子半径最小的是_________;
(5)![]() 的电子式为___________;
的电子式为___________;![]() 的电子式为_________;
的电子式为_________;
(6)在![]() 与
与![]() 的单质中,氧化性较强的是__________,用化学反应方程式证明:___________________________。
的单质中,氧化性较强的是__________,用化学反应方程式证明:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为________。
(2)配合物K4Fe(CN)6的中心离子的价电子排布图为______,该中心离子的配位数是_______。
(3)1mol HCN分子中含有σ键的数目为_______,HCN分子中碳原子轨道杂化类型是_______,与CN-互为等电子体的阴离子是_______。
(4)K2CO3中阴离子的空间构型为_________,其中碳原子的价层电子对数为____________。
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞中有________个氢键,若氢键键长为d nm,则晶体密度(g·cm-3)计算式为_______ (用NA表示阿伏加德罗常数的值)。
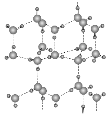
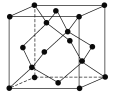
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯和丙烯是重要有机化工原料。
I.以乙烯为原料可以制备乙二醇和高分子化合物B。
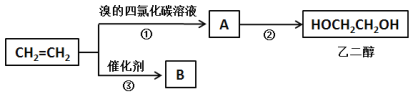
(1)①的化学方程式为______________。
(2)②为取代反应,通过A与NaOH溶液加热条件下完成转化。②的化学反应方程式为__________。
(3)③的反应类型为_______________,B的结构简式为________________。
II.丙烯酸乙酯天然存在于菠萝等水果中,是一种天然香料,也可以由乙烯和丙烯为原料合成。

(4)有机物E中的官能团是_________________。
(5) D与E反应生成丙烯酸乙酯的化学反应方程式为__________________。
(6)下列说法正确的是______________。
a.乙烯、丙烯是石油裂解的产物 b.乙二醇易溶于水
c.E能使酸性高锰酸钾溶液褪色 d.D可以由葡萄糖分解得到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)在医药、化工、民用等方面有广泛的应用。回答下面问题:
(1)最早制备H2O2使用的原料是易溶于水的BaO2和稀硫酸,发生反应的化学方程式是_____。BaO2的电子式为:__________。
(2)目前工业制备H2O2的主要方法是蒽醌法。反应流程如下:
![]()
已知:乙基蒽醌是反应中的催化剂。
①蒽醌法所用原料的物质的量之比为_____________。
②操作a是__________________。
③再生回收液的成分是______________________。
(3)测量过氧化氢浓度常用的方法是滴定法,某次测定时,取20. 00mL过氧化氢样品,加入过量硫酸酸化,用0. l000mol/L的KMnO4标准溶液滴定至终点,消耗10. 00mL,滴定时发生反应的离子方程式为____,该样品中H2O2的物质的量浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜是由铜和锌组成的合金,在黄铜中加入镍可显著提高黄铜在大气中和海水中的耐蚀性。回答下列问题:
(1)基态Ni2+的核外电子排布式为____________________,有_______个未成对电子。
(2)CuSO4溶液里逐滴滴入过量氨水,形成深蓝色溶液。
①深蓝色的溶液 是因为生成了一种配离子,其离子符号为____________________
其中配位原子是____________ 。
②NH3分子的空间构型是_______。NH3的键角______(填大于或小于)H2O,原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.CaCO3溶于CH3COOH溶液中,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O
B.向AlCl3溶液中通入过量NH3,反应的离子方程式为:Al3++4OH-=![]() +2H2O
+2H2O
C.下列四种离子因发生氧化还原反应而不能大量共存:K+、Fe3+、SCN-、Cl-
D.向稀硫酸中滴入Ba(OH)2溶液,反应的离子方程式为:Ba2++2OH-+2H++![]() =2H2O+BaSO4↓
=2H2O+BaSO4↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com