
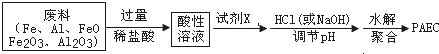
分析 该化合物中,Al元素化合价为+3价、Cl元素化合价为-1价、OH-化合价为-1价,化合物中各元素化合价代数和为0,据此判断Fe元素化合价;
废料中加入过量稀盐酸,Fe、Al、FeO、Fe2O3、Al2O3都和稀盐酸反应,导致溶液中溶质为HCl、FeCl2、AlCl3,因为Al、Fe具有还原性、铁离子具有氧化性,所以酸性溶液中不一定含有FeCl3,向溶液中加入试剂X,然后加入HCl或NaOH调节溶液pH,最后水解聚合得到PAEC,PAEC中铁元素化合价为+3价,酸性溶液中含有亚铁离子,试剂X能氧化亚铁离子且不能引进杂质,所以X最好是氯水,据此分析解答.
解答 解:该化合物中,Al元素化合价为+3价、Cl元素化合价为-1价、OH-化合价为-1价,化合物中各元素化合价代数和为0,Fe元素化合价=(6-n)×1+n×1-3×1=+3,
故答案为:+3;
废料中加入过量稀盐酸,Fe、Al、FeO、Fe2O3、Al2O3都和稀盐酸反应,导致溶液中溶质为HCl、FeCl2、AlCl3,因为Al、Fe具有还原性、铁离子具有氧化性,所以酸性溶液中不一定含有FeCl3,向溶液中加入试剂X,然后加入HCl或NaOH调节溶液pH,最后水解聚合得到PAEC,PAEC中铁元素化合价为+3价,酸性溶液中含有亚铁离子,试剂X能氧化亚铁离子且不能引进杂质,所以X最好是氯水;
①加入的盐酸足量,Fe、Al、FeO、Fe2O3、Al2O3都和稀盐酸反应,导致溶液中溶质为HCl、FeCl2、AlCl3,因为Al、Fe具有还原性、铁离子具有氧化性,所以酸性溶液中不一定含有FeCl3;铝离子和足量氢氧根离子反应生成四羟基合铝酸根离子,离子方程式为Al3++4OH-═[Al(OH)4]-,
故答案为:C;Al3++4OH-═[Al(OH)4]-;
②酸性溶液中含有亚铁离子,试剂X能氧化亚铁离子且不能引进杂质,所以X最好是氯水,铁、Al没有氧化性,硝酸具有氧化性但产生新的杂质,故选氯水,亚铁离子和氯气反应生成氯化铁,离子方程式为2Fe2++Cl2═2Fe3++2Cl-,
故答案为:C;2Fe2++Cl2═2Fe3++2Cl-;
③水解形成的聚合物分散在水中的粒子直径在1nm~100nm之间,则该分散系为胶体,胶体具有丁达尔效应,其检验方法为用一束光通过混合物,产生丁达尔现象,
故答案为:用一束光通过混合物,产生丁达尔现象.
点评 本题考查混合物的分离和提纯,为高频考点,涉及氧化还原反应、胶体性质、离子反应等知识点,明确流程图中发生的反应及溶液中溶质及其性质是解本题关键,注意除杂时不能产生新的杂质,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO、NO、NaH、N2 | |
| B. | SO2、N${\;}_{2}^{+}$、N${\;}_{3}^{-}$、CNO- | |
| C. | CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、BeCl2 | |
| D. | SiF4、SiO${\;}_{4}^{4-}$、SO${\;}_{4}^{2-}$、PO${\;}_{4}^{3-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 草酸(H2C2O4)是一种重要的化工产品.草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值进行如下实验:
草酸(H2C2O4)是一种重要的化工产品.草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 湿法 | 强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和滴定实验中,盛装待测液的锥形瓶没有润洗,对实验结果无影响 | |
| B. | 用容量瓶配制一定物质的量浓度的溶液,定容时俯视刻度线,所配溶液浓度偏低 | |
| C. | 用润湿的pH试纸测某溶液的pH,测定结果不一定有误差 | |
| D. | 测定中和热的实验中,将碱液缓慢倒入酸溶液中,所测中和热值偏低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com