
| A. | ①③ | B. | ①③④⑤ | C. | ①②③④ | D. | ①④⑤ |
分析 3SnCl2+12Cl-+2HNO2+6H+═N2+3SnClxy-+4H2O,由电荷守恒可知,y为2,由原子守恒可知x=6,Sn元素的化合价升高,N元素的化合价降低,结合氧化还原反应中还原剂的还原性大于还原产物的还原性及氧化剂的氧化性大于氧化产物的氧化性来解答.
解答 解:①N元素的化合价降低,则氧化剂是HNO2,故正确;
②Cl元素的化合价不变,则该反应中不能判断Cl-、N2还原性强弱,故错误;
③每生成2.8g N2,得到电子为$\frac{2.8g}{28g/mol}$×2×(3-0)=0.6mol,由电子守恒可知还原剂失去的电子为0.6mol,故正确;
④由原子守恒可知x为6,由电荷守恒可知y为2,故正确;
⑤Sn元素失去电子被氧化,则SnClxy-是氧化产物,故正确;
故选B.
点评 本题考查了氧化还原反应,为高频考点,明确元素化合价变化是解本题关键,注意守恒法的应用及氧化还原反应基本概念,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | H+、Fe3+、I-、SO${\;}_{4}^{2-}$ | B. | OH-、Na+、HCO${\;}_{3}^{-}$、Cl- | ||
| C. | K+、Ca2+、NO${\;}_{3}^{-}$、SiO${\;}_{3}^{2-}$ | D. | K+、Na+、OH-、AlO${\;}_{2}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| 沉淀区间(pH) | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、乙烯和苯在工业上都可以通过石油分馏得到 | |
| B. | 苯和乙烯都可使溴的四氯化碳溶液褪色 | |
| C. | 甲烷、乙烯、乙醇都能发生氧化反应 | |
| D. | 汽油、柴油属于烃,植物油属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3:2:1 | |
| B. | n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为$\frac{35.5m}{n}$ | |
| C. | 标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32 | |
| D. | 5.6 g CO和22.4 L CO2中含有的碳原子数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 叙述I | 叙述II |
| A.NH4Cl受热易分解 | 可用加热法除去I2中的NH4Cl |
| B.往氯化钙溶液中通入足量的CO2 先有白色沉淀生成,后沉淀溶解 | CaCO3不溶于水,Ca(HCO3)2可溶于水 |
| C.水玻璃具有黏性 | 盛装烧碱溶液的试剂瓶不能用玻璃塞 |
| D.利用丁达尔现象区分氢氧化铁胶体和浓的氯化铁溶液 | 往氢氧化钠溶液中滴加饱和氯化铁溶液,加热至红褐色制得胶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 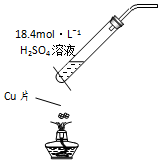 用图装置制取SO2 | |
| B. | 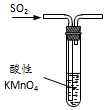 图装置中溶液的颜色变浅,说明SO2具有漂白性 | |
| C. | 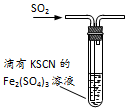 图装置中溶液的颜色变浅,说明SO2具有还原性 | |
| D. |  图装置中产生淡黄色沉淀,说明SO2或H2SO3具有氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com