
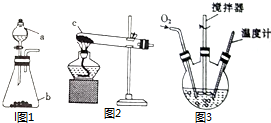
 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:
氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:分析 (1)①图1中固体与液体在不加热条件下得到氧气,可以是过氧化氢在二氧化锰作催化剂条件下分解获得氧气;
②高锰酸钾加热分解生成锰酸钾、二氧化锰、氧气;
(2)①加热控制温度60~70℃,低于水的温度,采取水浴加热,搅拌可以使反应物充分接触,加快反应速率;
②硝酸具有强氧化性,可以氧化CuCl;
③CuCl是微溶于水,不溶于乙醇,用乙醇洗涤除去杂质,减小溶解导致的损失;
(3)①加入适量稀硫酸酸化,提高KMnO4的氧化能力;
②由电子转移守恒计算CuCl的物质的量,进而计算CuCl质量分数.
解答 解:(1)①图1中固体与液体在不加热条件下得到氧气,可以是过氧化氢在二氧化锰作催化剂条件下分解获得氧气,则a中盛放H2O2溶液,b为MnO2,
故答案为:H2O2溶液;MnO2;
②高锰酸钾加热分解生成锰酸钾、二氧化锰、氧气,反应方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,
故答案为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(2)①加热控制温度60~70℃,低于水的温度,采取水浴加热,受热均匀,便于控制温度,搅拌可以使反应物充分接触,加快反应速率,
故答案为:水浴加热;使反应物充分接触,加快反应速率;
②硝酸具有强氧化性,可以氧化CuCl,导致CuCl的产率降低,
故答案为:CuCl的产率降低;
③CuCl是微溶于水,不溶于乙醇,用乙醇洗去固体表面可溶性杂质,减小溶解导致的损失,
故答案为:洗去固体表面可溶性杂质,减小溶解导致的损失;
(3)①加入适量稀硫酸,提高KMnO4的氧化能力,
故答案为:酸化,提高KMnO4的氧化能力;
②由电子转移守恒:n(CuCl)=5n(KMnO4)=5×0.2000mol•L-1×0.015L=0.015mol,CuCl质量分数为$\frac{0.015mol×99.5g}{1.600g}$×100%=93.28%,
故答案为:93.28%.
点评 本题考查物质制备实验、氧气制备、物质含量测定、氧化还原反应滴定等,注意对题目信息的运用,是对学生综合能力的考查.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去Na2CO3固体中少量NaHCO3:加热 | |
| B. | 除去CO2中少量SO2:通过饱和NaHCO3溶液 | |
| C. | 除去氯气中少量氯化氢:通过氢氧化钠溶液 | |
| D. | 除去氧化铁中少量氧化铝:加入过量的烧碱溶液后,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
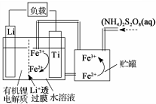
| A. | Li+透过膜除允许Li+通过外,还允许H2O分子通过 | |
| B. | 放电时,进入贮罐的液体发生:S2O32-+2Fe2+=2Fe3++2SO42- | |
| C. | 充电时,钛电极与外电源的正极相连 | |
| D. | 充电时,电池内部发生的总反应为Li++Fe2+=Li+Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
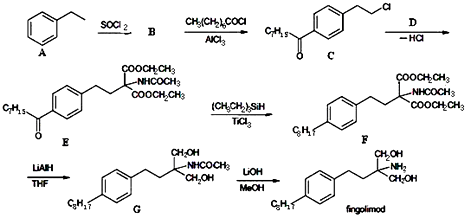
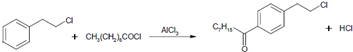 .
.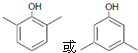 .
.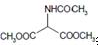 等主要原料,合成医药中间体:
等主要原料,合成医药中间体: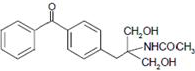 (无机原料任选).合成路线流程图示例如下:
(无机原料任选).合成路线流程图示例如下: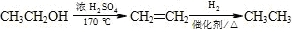
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键存在于原子之间,也能存在于分子与离子之间 | |
| B. | 两个原子之间的相互作用叫做化学键 | |
| C. | 离子键是阴、阳离子之间的吸引力 | |
| D. | 化学键通常指的是任意两个或多个原子之间强烈的相互作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-的结构示意图: | |
| B. | 用电子式表示氯化氢分子的形成过程: | |
| C. | O-18原子的符号:${\;}_{8}^{18}$O | |
| D. | CO2分子的结构式:O=C=O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气燃烧 | |
| B. | 硫酸与氢氧化钡溶液反应 | |
| C. | 铁与盐酸反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的充分反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质水解反应:HCO3-+H2O?H3O++CO32- | |
| B. | 离子浓度关系:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 微粒浓度关系:c(Na+)═2[c(H2CO3)+c(HCO3-+c(CO32-)] | |
| D. | 微粒浓度关系:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com