

 2MnCl2+Cl2↑+4H2O
2MnCl2+Cl2↑+4H2O 2MnCl2+Cl2↑+4H2O。
2MnCl2+Cl2↑+4H2O。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源:不详 题型:问答题

 Cu2++
Cu2++ Cl-+
Cl-+ SO32-+
SO32-+ =
= [CuCl2]-+
[CuCl2]-+ +
+
 CuCl+Cl- K=2.32
CuCl+Cl- K=2.32 Cu+(aq)+Cl- Ksp=1.2×10-6
Cu+(aq)+Cl- Ksp=1.2×10-6
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.若X为碳棒,开关K置于M处,则溶液中的H+移向Fe极 |
| B.若X为碳棒,开关K置于N处,转移0.2mole一时析出0.lmolO2 |
| C.若X为铜棒,开关K置于M或N处,均可减缓铁的腐蚀 |
| D.若X为锌棒,开关K置于M或N处,锌电极上反应均为Zn-2e一=Zn2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.镁作Y电极 |
| B.电池工作时,Na+向负极移动 |
| C.废液的pH大于NaClO溶液的pH |
| D.X电极上发生的反应为ClO-+2H2O-4e-===ClO3-+4H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。
LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。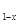 FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe—
FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe— XLi++6C,写出电池放电时的电极反应的化学方程式 。
XLi++6C,写出电池放电时的电极反应的化学方程式 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

 (aq)
(aq) PbCO3(s)+SO42-(aq)
PbCO3(s)+SO42-(aq) )=c(SO42-)
)=c(SO42-)
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.构成原电池正极和负极的材料必须是两种金属 |
| B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极 |
| C.马口铁(镀锡铁)破损时与电解质溶液接触锡先被腐蚀 |
| D.原电池工作时,电解质溶液中的阴离子向负极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com