解答:解:(1)装置Ⅱ的冰水能够降低反应体系的温度,避免三氧化硫在与装置D中的溶液反应时生成酸雾,影响吸收效果,
故答案为:降低反应体系温度,防止大量酸雾产生;
(2)增大反应物氧气的浓度,可以通过二氧化硫的转化率,且通过不断通入氧气,可以将装置中的三氧化硫和二氧化硫驱赶到后面的装置中,以便被充分吸收,
故答案为:增大二氧化硫的转化率,使三氧化硫、二氧化硫充分被后续装置吸收;
(3)A.澄清石灰水能够与二氧化硫反应,无法达到测定三氧化硫的目的,故A错误;
B.足量小苏打溶液,亚硫酸的酸性大于碳酸,二氧化硫能够与碳酸氢钠溶液反应,无法满足测定三氧化硫合理的目的,故B错误;
C.足量的氯化钡溶液,二氧化硫不与氯化钡溶液反应,而三氧化硫能够与氯化钡溶液反应生成硫酸钡沉淀,可以沉淀三氧化硫的含量,故C正确;
D.足量硝酸钡溶液,二氧化硫能够与硝酸钡溶液反应生成硫酸钡沉淀,无法达到沉淀三氧化硫的目的,故D错误;
故选:C;
(4)生成白色沉淀为硫酸钡、红棕色气体为一氧化氮与氧气反应生成的二氧化氮,发生反应的离子方程式为:3SO
2+3Ba
2++2NO
3-═3BaSO
4↓+2NO↑+4H
+,
故答案为:3SO
2+3Ba
2++2NO
3-═3BaSO
4↓+2NO↑+4H
+;
(5)若n(SO
2):n(NaOH)=1:2反应按照反应:SO
2+2NaOH═Na
2SO
3+H
2O;若n(SO
2):n(NaOH)=1:1,反应按照反应SO
2+NaOH═NaHSO
3;装置Ⅳ中有40mL 2.5mol?L
-1 NaOH溶液中n(NaOH)=0.1mol,n(SO
2)=
=0.075mol;n(SO
2):n(NaOH)=0.075:0.1=3:4,所以生成产物为亚硫酸钠和亚硫酸氢钠;
设生成亚硫酸钠xmol、亚硫酸氢钠ymol,
则:
,解得:
,
即n(Na
2SO
3):n(NaHSO
3)=1:2,
所以反应的化学方程式为:3SO
2+4NaOH═Na
2SO
3+2NaHSO
3+H
2O,
故答案为:3SO
2+4NaOH═Na
2SO
3+2NaHSO
3+H
2O;
(6)若从锥形瓶溶液中得到的沉淀质量为mg,则mg为硫酸钡沉淀,n(BaSO
4)=n(SO
3)=
mol,已经知道转化了的二氧化硫,只要再告诉反应前的二氧化硫的物质的量或者反应后的二氧化硫的物质的量,就可以计算出二氧化硫的转化率,所以实验时还需要测定的数据为B或者AD,
若装置A中亚硫酸钠减少的质量bg,则生成的二氧化硫的物质的量为:n(Na
2SO
3)=n(SO
2)
mol,二氧化硫的转化率为:
×100%;
若知道装置F增加的质量ag、装置E增加的质量dg,则剩余的二氧化硫的物质的量为:
mol,二氧化硫的转化率为:
×100%,
故答案为:B或AD;
×100%或
×100%.

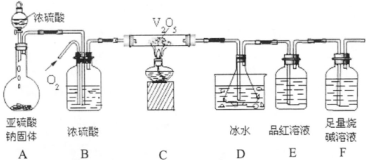


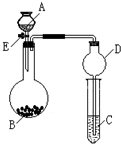 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
 (2011?佛山一模)纯碱、烧碱等是重要的化工原料.
(2011?佛山一模)纯碱、烧碱等是重要的化工原料.