
【题目】肼(N2H4)的性质类似于氨气,易溶于水,是塑料、橡胶发泡剂的原料。将肼蒸汽通入CuO胶体中,可发生如图所示的转化
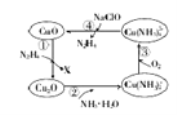
(1)图示的转化中,属于非氧化还原反应的是_________(填序号)。
(2)转化①中,氧化剂与还原剂的物质的量之比为4:1,则X的化学式为______。
(3)转化②中,反应一段时间后,溶液中n(OH—)_________(填“增大”“减小”或“不变”)
(4)加入NaClO时发生的反应为Cu(NH3)42++2ClO—+2OH—=Cu(OH)2↓+2N2H4↑+2Cl—+2H2O。该反应需在80℃以上进行,其目的除加快反应速率外,还有_______、__________。
(5)若①中参加反应的CuO物质的量为0.4mol,按图示转化过程进行后,④中生成的CuO物质的量也等于0.4mol,则③中参加反应的O2的物质的量与④中参加反应的NaClO的物质的量之比为______。
【答案】(1)②(1分)
(2)N2(2分)
(3)增大(2分)
(4)使氢氧化铜分解;降低肼的溶解度,促使其从溶液中逸出(各1分)
(5)1:8(2分)。
【解析】
试题分析:(1)非氧化还原反应即无元素化合价变化的反应,反应②中铜元素、氮元素和氢元素以及氧元素的化合价均没有变化,故为非氧化还原反应,其它反应中都有元素化合价的变化,都属于氧化还原反应,故图示的转化中,属于非氧化还原反应的是②;(2)在反应①中,N2H4做还原剂,CuO做氧化剂,则X为氧化产物,设X中氮元素为a价,则根据氧化剂与还原剂的物质的量之比为4:1有:4×(2-1)=1×2×(a-2+2),可解得a=0,即X为氮气,X的化学式为:N2;(3)转化②中的离子方程式为:Cu2O+4NH3H2O= 2Cu(NH3)2++ 2OH-+3H2O,故溶液中氢氧根的物质的量增大;(4)加入NaClO时发生的反应为Cu(NH3)42++2ClO—+2OH—=Cu(OH)2↓+2N2H4↑+2Cl—+2H2O。该反应需在80℃以上进行,其目的除加快反应速率外,还有就是溶液的温度高时氢氧化铜分解,且N2H4气体溶解度随温度升高而降低,从溶液中逸出,从而促进反应向正反应方向进行;(5)在整个转化过程中满足铜元素的守恒,故若①中参加反应的CuO物质的量为0.4mol,按图示转化过程进行后,Cu(NH3)2+的物质的量是0.4mol,发生反应③后Cu(NH3)2+被O2氧化产生Cu(NH3)42+,根据电子守恒可知反应消耗O2的物质的量是(0.4mol×1)÷4=0.1mol;根据反应④Cu(NH3)42++2ClO—+2OH—=Cu(OH)2↓+2N2H4↑+2Cl—+2H2O可知0.4mol Cu(NH3)42+反应消耗NaClO的物质的量是0.4mol×2=0.8mol,所以③中参加反应的O2的物质的量与④中参加反应的NaClO的物质的量之比为0.1mol:0.8mol=1:8。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】(1)NO2与SO2混合可发生反应:SO2(g)+NO2(g)![]() SO3(g)+NO(g);①将一定量的NO2与SO2置于绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的趋势如图所示。由图可知下列说法正确的是_______(填字母)。
SO3(g)+NO(g);①将一定量的NO2与SO2置于绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的趋势如图所示。由图可知下列说法正确的是_______(填字母)。

A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量高于生成物的总能量
D.△t1=△t2时,SO2的消耗量:a~b段大于b~c段
(2)在一定温度下的某容积不变的2L密闭容器中,1molCO和2molH2O(g)反应,建立下列化学平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
①能确定上述可逆反应在一定条件下已达到化学平衡状态的是( )
a.体系的压强不再发生变化
b.V(CO)=V(H2O)
c.气体平均摩尔质量不变化
d.1 mol H-H键断裂的同时断裂2 mol H-O键
②在容器中再加入一定量的N2而使容器内压强增大,则反应速率________(填“增大”“减小”“不变”;后同),降低容器的温度则反应速率________。
③反应第4min时,反应达到最大限度,CO转化率为60%,0~4min平均速率v(H2O)=_________,CO2的体积分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的强酸性溶液中,能大量共存的是( )
A.Na+、NO3-、Al3+、Cl- B.Na+、CO32-、Ca2+、NO3-
C.K+、SO42-、Cl-、Cu2+ D.Ba2+、Cl-、K+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的正确组合是( )
类别 组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO2 | SiO2 | H2SO4 | KOH | NaHCO3 |
B | CO | Na2O | HCl | NaOH | NaCl |
C | SO2 | CuO | CH3COOH | Na2CO3 | CaF2 |
D | SO3 | CaO | HNO3 | Ca(OH)2 | CaCO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源和环境保护是世界各国关注的热点话题。请回答下列问题:
Ⅰ.目前“低碳经济”正成为科学家研究的主要课题。甲烷自热重整是一种先进的制氢方法,其反应方程式为CH4(g) +H2O (g) =CO (g) +3H2(g) 。
阅读下图,计算该反应的反应热△H=____________kJ·mol-1。
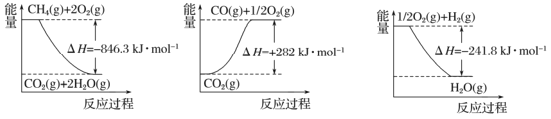
Ⅱ.收集和利用CO2是环境保护的热点课题。
500℃时,在容积为1L的密闭容器中充入1 mol CO2和3 mol H2,发生如下反应:CO2(g) +3H2 (g) ![]() CH3OH (g) +H2O (g) △H<0,测得CO2和CH3OH的浓度与时间的关系如图所示。
CH3OH (g) +H2O (g) △H<0,测得CO2和CH3OH的浓度与时间的关系如图所示。
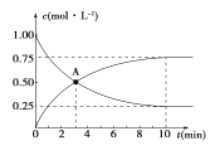
(1)0~10 min内v(H2)=_____________,
A点含义是_____________。
该反应平衡常数表达式K=____________。
(2)反应在500℃达到平衡后,改变反应温度为T,CH3OH的浓度以每分钟0.030 mol/L逐渐增大,经5 min又达到新平衡。T____________(填“>”、“<”或“=”)500℃,判断理由是___________________。
(3)温度为T时,反应达到平衡后,将反应容器的容积增大一倍。平衡向____________(填“正”或“逆”)反应方向移动,判断理由是____________。
Ⅲ.电化学法处理SO2是目前研究的热点。
利用双氧水吸收SO2可消除SO2污染,设计装置如图所示。
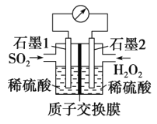
(1)石墨1为___________(填“正极”或“负极”);
正极的电极反应式为____________。
(2)若11.2 L(标准状况)SO2参与反应,则迁移H+的物质的量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B ,C ,D ,E
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程: 。
(3)写出A、B两元素的最高价氧化物的水化物相互反应的化学方程式: 。
(4)写出B、E两元素的最高价氧化物的水化物相互反应的离子方程式: 。
(5)C、D、E的氢化物稳定性由强到弱依次为:(用化学式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源开发前景十分广阔。海水晒盐能够得到粗盐和卤水,卤水中含有MgCl2、KCl和MgSO4等物质,右图是它们的溶解度曲线。则下列说法不正确的是

A.t1℃时,三种物质的饱和溶液中,溶质质量分数最大的是MgCl2
B.t1℃时,分别在100g水中溶解了等质量的MgCl2、KCl,两溶液都可达到饱和
C.t2℃时,KCl和MgSO4两种物质的溶解度相同
D.将卤水加热到t2℃ 以上,析出的晶体主要为MgSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com