
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:
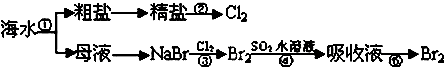
| A、实验室进行①的操作需用到坩埚、玻璃棒、酒精灯 |
| B、②是一个将电能转化为化学能的过程 |
| C、③④⑤涉及的反应均为氧化还原反应 |
| D、NaCl溶液蒸发结晶时,蒸发皿中有大量晶体析出时停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾和氯气均可用于水的消毒、杀菌 |
| B、地沟油不能食用,但可以在循环经济中发挥作用 |
| C、硬铝属于合金材料,餐桌上的瓷盘属于硅酸盐制品 |
| D、不需要通过化学反应就能从海水中获得食盐和淡水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNa2O和Na2O2的混合物中含有的阴、阳离子总数是3NA |
| B、常温下,1L0.1 mol?L-1的NH4NO3溶液中含有的氮原子数为0.2NA |
| C、46g有机物C2H6O中含有的H-O键的数目为NA |
| D、标准状况下,将0.1molCl2通入足量NaOH溶液中,反应转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4HSO4溶液中加入足量的Ba(OH)2溶液:OH-+H++Ba2++SO4-2=BaSO4↓+H2O |
| B、小苏打溶液中加入足量的Ca(OH)2溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| C、用稀硝酸洗涤试管内壁银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
| D、向Mg(OH)2悬浊液中滴加FeCl3溶液,生成红褐色沉淀:3OH-+Fe3+=Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最外层只有1个电子的元素不一定是金属元素 |
| B、最外层有2个电子的元素不一定是金属元素 |
| C、原子核外各层电子数相等的元素一定是金属元素 |
| D、最外层电子数为7的原子,最高正价为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只存在乙酸分子中 |
| B、存在于乙酸乙酯、乙醇中 |
| C、只存在于乙醇分子中 |
| D、只存在于水分子中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
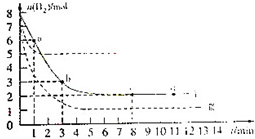 随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.
随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com