
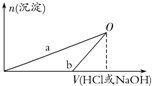
 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.| A. | b曲线表示的是向X溶液中加入NaOH溶液 | |
| B. | 在O点时两方案中所得溶液浓度相等 | |
| C. | 方案②中对应的O点HCl恰好反应完 | |
| D. | X溶液显酸性,Y溶液显碱性 |
分析 由实验方案可知,方案①:2.7gAl$\stackrel{100mL稀盐酸}{→}$X(AlCl3)溶液$\stackrel{NaOH溶液}{→}$Al(OH)3沉淀,
方案②:2.7gAl$\stackrel{100mLNaOH溶液}{→}$Y(NaAlO2)溶液$\stackrel{稀盐酸}{→}$Al(OH)3沉淀,
n(Al)=$\frac{2.7g}{27g/mol}$=0.1mol,n(HCl)=3 mol/L×0.1 L=0.3 mol,n(NaOH)=3 mol/L×0.1 L=0.3mol,由2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,酸完全反应,而NaOH剩余,则图中b表示向Y中加盐酸,a表示向X中加NaOH,以此来解答.
解答 解:由实验方案可知,方案①:2.7gAl$\stackrel{100mL稀盐酸}{→}$X(AlCl3)溶液$\stackrel{NaOH溶液}{→}$Al(OH)3沉淀,
方案②:2.7gAl$\stackrel{100mLNaOH溶液}{→}$Y(NaAlO2)溶液$\stackrel{稀盐酸}{→}$Al(OH)3沉淀,
n(Al)=$\frac{2.7g}{27g/mol}$=0.1mol,n(HCl)=3 mol/L×0.1 L=0.3 mol,n(NaOH)=3 mol/L×0.1 L=0.3mol,由2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,酸完全反应,而NaOH剩余,则图中b表示向Y中加盐酸,a表示向X中加NaOH,
A.由上述分析可知,X中溶质只有AlCl3,而Y中溶质为NaAlO2、NaOH,故A错误;
B.在O点时,沉淀达到最大,所得溶液中只有氯化钠溶质,与向X溶液和Y溶液中分别加入NaOH和HCl的浓度及体积相等,根据原子守恒,所以O点时两方案中所得溶液浓度相等,故B正确;
C.b中开始不生成沉淀,则b表示向Y中加盐酸,沉淀最大,此时溶液是单一溶液氯化钠,盐酸应完全反应,故C正确;
D.X中溶质只有AlCl3,是强酸弱碱盐,溶液呈酸性,Y中溶质为NaAlO2、NaOH的混合溶液溶液呈碱性,故D正确;
故选A.
点评 本题考查性质实验方案的设计,为高频考点,把握发生的反应及量的关系、图象分析为解答的关键,侧重分析、计算、实验能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 都易溶于水,相同温度下,碳酸钠的溶解度大于碳酸氢钠 | |
| B. | 水溶液都呈碱性,相同物质的量浓度时,碳酸钠溶液的pH大于碳酸氢钠溶液 | |
| C. | 碳酸钠的稳定性比碳酸氢钠强,碳酸氢钠受热易分解 | |
| D. | 碳酸钠与碳酸氢钠溶液可以用澄清石灰水鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10s时,再加入一定量的D,平衡向右移动 | |
| B. | 10s时用D物质表示的速率为0.04mol/(L•S) | |
| C. | 10s时,容器中B的浓度为1.6mol•L-1 | |
| D. | 达到平衡时A的转化率为60%,若要在相同条件下反应达到平衡时A的转化率仍为60%,起始加入n(A)=n(B)即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④ | C. | ①③④ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌片是正极,铜片上有气泡冒出 | B. | 电流方向是从锌片流向铜片 | ||
| C. | 溶液中硫酸的物质的量不断减小 | D. | 电解液的pH保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物在很多方面有重要的用途.
氮及其化合物在很多方面有重要的用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com