
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O) (相对分子质量为990)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。

已知:(1)Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13;(2)铅与冷盐酸、冷硫酸几乎不起作用。
请回答下列问题:
(1)写出步骤①“转化”的化学方程式______________________________________。
(2)步骤③“酸溶”,最适合选用的酸为______________,为提高酸溶速率,可采取的措施是__________(任意写出一条)。
(3)若步骤④沉铅”后的滤液中c(Pb2+)=1.82×10-5mol/L,则此时c(SO42-)=______mol/L。
(4)从原子利用率的角度分析该流程的优点为_______________________。
(5)步骤⑥“合成”三盐的化学方程式为____________________________。若得到纯净干燥的三盐49.5t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为__ % (结果保留一位小数)
【答案】 PbSO4+Na2CO3=PbCO3↓+Na2SO4 硝酸(或HNO3) 适当升温(适当增加硝酸浓度、减小滤渣颗粒大小等合理答案均可) 1×10-3 滤液2(HNO3溶液)可以循环利用 4PbSO4+6NaOH![]() 3PbO·PbSO4·H2O+3Na2SO4+2H2O 51.8
3PbO·PbSO4·H2O+3Na2SO4+2H2O 51.8
【解析】分析:由于PbSO4溶解度较大,又不溶于稀酸,而PbCO3溶解度小,能溶于稀酸,为提高原料的利用率,加入碳酸钠将硫酸铅转化为碳酸铅,然后用硝酸将PbO、Pb 和PbCO3转化为可溶性铅盐,再向其中加入硫酸,使铅元素转化为PbSO4,所以滤液2中主要为硝酸,可进行循环使用,然后向硫酸铅中加入氢氧化钠溶液,在适当条件下生成“三盐”,分离处理后得到所要的产品。
详解:(1) 由于Ksp(PbSO4)=1.82×10-8 > Ksp(PbCO3)=1.46×10-13,所以步骤①加入碳酸钠溶液,把硫酸铅转化为碳酸铅,以提高原料的利用率,反应的化学方程式为PbSO4+ Na2CO3= PbCO3↓ +Na2SO4。
(2) 由于铅与冷盐酸、冷硫酸几乎都不反应,所以用硝酸溶解铅及其化合物,且能生成可溶性铅盐,有利于转化为最终产品,为提高溶解速率,可适当升温,或适当增加硝酸浓度,或将滤渣粉碎增大表面积等。
(3)根据Ksp(PbSO4)=1.82×10-8,若滤液中c(Pb2+)=1.82×10-5mol/L,则溶液中c(SO42-)= ![]() =
= ![]() =1×10-3 mol/L。
=1×10-3 mol/L。
(4) 从原子利用率的角度分析该流程的优点是滤液2即HNO3溶液可以循环使用,节约原料,降低成本。
(5)根据题目叙述,结合转化关系,则步骤⑥“合成”三盐的化学方程式为4PbSO4+6NaOH![]() 3PbO·PbSO4·H2O+3Na2SO4+2H2O;设铅泥中铅元素的质量分数为x,根据铅元素守恒可得:
3PbO·PbSO4·H2O+3Na2SO4+2H2O;设铅泥中铅元素的质量分数为x,根据铅元素守恒可得:![]() =
= ![]() ,解得x=0.5175,所以该铅泥中铅元素的质量分数为51.8%。
,解得x=0.5175,所以该铅泥中铅元素的质量分数为51.8%。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,175℃时分解。
Ⅰ.用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。
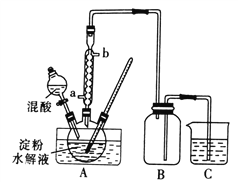
实验步骤如下
①糖化:先将淀粉水解为葡萄糖;
②氧化:在淀粉水解液中加入混酸(质量之比为3:2的65%HNO3与98%HSO4的混合物),在55~60℃下水浴加热发生反应;
③结晶、蒸发、干燥:反应后溶液经冷却、减压过滤,即得草酸晶体粗产品。
(1)装混酸的仪器名称为________;步骤②中,水浴加热的优点为__________。
(2)“②氧化”时发生的主要反应如下,完成下列化学方程式:
___C6H12O6+___HNO3 ![]() ___H2C2O4+9NO2↑+3NO↑+ ______
___H2C2O4+9NO2↑+3NO↑+ ______
(3)称取mg草酸晶体粗产品,配成100mL溶液。取20.00mL于锥形瓶中,用amoL·L-1KMnO4标准液标定,只发生
5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O反应,消耗KMnO4标准液体积为VmL,则所得草酸晶体(H2C2O4·2H2O)的纯度为___________。
Ⅱ.证明草酸晶体分解得到的产物
(4)甲同学选择下述装置验证产物CO2,装置B的主要作用是__________。
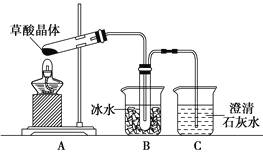
(5)乙同学认为草酸晶体分解的产物中除了CO2、H2O应该还有CO,为进行验证,选用甲同学实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。
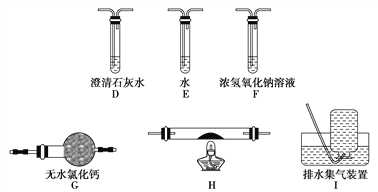
①乙同学的实验装置中,依次连接的合理顺序为A、B、_____________。其中装置H反应管中盛有的物质是________________________。
②能证明草酸晶体分解产物中有CO的现象是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1 mol·Lˉ1的NaOH溶液和氨水,下列说法正确的是
A. c(NH3H2O) + c(![]() ) = c(Na+)
) = c(Na+)
B. NH3·H2O的电离方程式:NH3H2O ===![]() + OH-
+ OH-
C. 氨水的pH大于NaOH溶液
D. 将浓度为0.1 mol·Lˉ1的盐酸和氨水等体积混合后,所得溶液中:c(OH-) > c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合溶液中逐渐通入CO2气体至过量,生成沉淀的物质的量(n)和通入CO2气体的(V) 的关系如图所示,试回答:

(1)0到a点之间的反应的离子方程式__________
(2)a到b点之间的反应的离子方程式__________
(3)b点之后的反应的离子方程式______________
(4)c 点CO2的体积__________mL(同温同压下)。
(5) 混合溶液中Ba(OH)2和NaOH 的物质的量之比为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个体重50 kg的健康人含铁元素2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
(1)人体中经常进行Fe2+与Fe3+的转化,可表示为Fe2+![]() Fe3+。在过程A中,Fe2+作________剂,过程B中,Fe3+被__________。
Fe3+。在过程A中,Fe2+作________剂,过程B中,Fe3+被__________。
(2)“服用维生素C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这个反应中作_____剂,具____性。
(3)已知下列反应在一定条件下发生:

在以上的反应中,Fe2+实际上起着 ______________的作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是
A. 分散质粒子直径与分散系种类:![]()
B. NaOH溶液与CO2反应后溶液中的钠盐: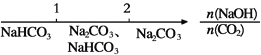
C. AlCl3溶液中滴加NaOH溶液后铝的存在形式:![]()
D. Na与O2反应的产物:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个2 L恒容的容器中,分别发生反应A(g)+3B(g)![]() 2C(g),5 min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。下列说法正确的是( )
2C(g),5 min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。下列说法正确的是( )

A. 乙中5 min内C的反应速率为0.16 mol·L-1·min-1
B. 达到平衡时,丙中A的浓度是甲中的2倍
C. 丙中反应的平衡常数大于甲中反应的平衡常数
D. 达平衡时,甲、乙两容器中C物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室的硫酸试剂标签上的部分内容。据此,下列说法正确的是
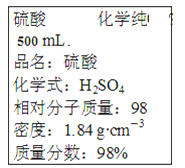
A. 该硫酸的物质的量浓度为9.2mol·L-1
B. 1mol Fe与足量的稀硫酸反应,标准状况下产生44.8L气体
C. 若实验室需要4.6 mol/L的稀硫酸500mL,配制稀硫酸时则应量取该硫酸125.0mL
D. 该硫酸与等体积的水混合后,所得溶液的质量分数等于49%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)下列说法正确的是
A. 按系统命名法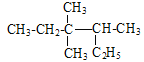 的名称为3,3-二甲基-2-乙基戊烷
的名称为3,3-二甲基-2-乙基戊烷
B. 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应
C. 分子式为C5H12O的醇共有8 种,其中能催化氧化成醛的同分异构体有3 种
D. 聚乙烯( PE)和聚氯乙烯( PVC)的单体都是不饱和烃,这些单体均能使溴水褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com