
.下列关于金属钠的叙述错误的是
A.金属钠可以保存在煤油中
B.金属钠着火时,可用泡沫灭火器来灭火
C.钠与熔融的四氯化钛反应可制取钛
D.实验时用剩的钠块应该放回原试剂瓶
【知识点】元素化合物 C1
【答案解析】B 解析:A、金属钠容易被空气中氧气氧化;也容易与水反应。而水、氧气都不溶于煤油,所以选择存放在煤油中。钠不与煤油反应且密度比煤油大。故A正确;B、泡沫灭火剂不可以,钠在燃烧时与氧气反应生成过氧化钠,过氧化钠会和泡沫灭火剂中的CO2反应生成氧气助燃, 2 Na2O2 + 2 CO2 = 2 Na2CO3 + O2 此反应放出氧气,促进金属纳的反应,使火焰更加剧烈 可以用沙子扑灭。故B错误;C、钠是强还原剂,故C正确;D、金属钠比较活泼,实验时用剩的钠块应该放回原试剂瓶,故D正确。
【思路点拨】本题考查了Na的性质及保存,难度不大,注意平时积累。


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
化学与生活息息相关,下列说法不正确的是
A.干燥的Cl2和氯水均能使鲜花褪色
B.Si可用于制造半导体材料
C.次氯酸钠溶液是生活中常用的消毒剂
D.经常食用含明矾的食品能中和过多的胃酸
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)相同物质的量浓度、相同体积的NaCl、MgCl2、AlCl3溶液,分别与足量的AgNO3溶液反应,生成沉淀的质量之比为________。
(2)向等体积、等浓度的AgNO3溶液中,分别加入相同体积的NaCl、MgCl2、AlCl3溶液,恰好使它们中的Cl-完全转化为AgCl沉淀,则三种溶液的物质的量浓度之比为________。
(3)Na、Mg、Al分别与足量的硫酸溶液反应,当生成气体的质量相同时,消耗Na、Mg、Al的物质的量之比为________。
(4)足量的Al分别与等浓度的硫酸、氢氧化钠溶液反应,当生成气体的质量相同时,硫酸溶液和氢氧化钠溶液的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是
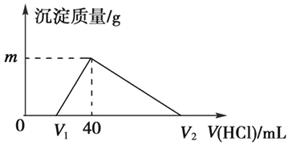
A.原合金质量为 0.92 g B.产生氢气的体积为896 mL(标准状况下)
C.图中m的值为1.56 D.图中V2的值为60
查看答案和解析>>
科目:高中化学 来源: 题型:
往甲、乙、丙、丁四个烧杯内分别放入0.1 mol的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100 mL 的水,搅拌,使固体完全溶解。则甲、乙、丙、丁溶液中溶质的质量分数大小的顺序是 ( )
A.甲<乙<丙<丁 B.甲=丁<乙=丙 C.丁<甲<乙=丙 D.丁<甲<乙<丙
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知A和B均为第3周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1 817 | 2 745 | 11 578 |
| B | 738 | 1 451 | 7 733 | 10 540 |
A通常显________价,A的电负性________B的电负性(填“>”“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因____________________________________。
| 共价键 | C—C | C—N | C—S |
| 键能/kJ·mol-1 | 347 | 305 | 259 |
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是__________。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
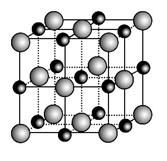
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3 401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:________________。
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有__________个。
(4)金属阳离子含有的未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是__________。
(5)某配合物的分子结构如图所示,其分子内不含有________(填序号)。
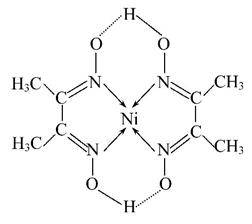
A.离子键 B.极性键 C.金属键 D.配位键
E.氢键 F.非极性键
(6)科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中的CO2。
若有1 mol CH4生成,则有______molσ键和______molπ键断裂。
查看答案和解析>>
科目:高中化学 来源: 题型:
醋酸溶液中存在电离平衡:CH3COOH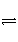
 H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.CH3COOH溶液中离子浓度的关系满足:[H+]=[OH-]+[CH3COO-]
B.0.1 mol·L-1的CH3COOH溶液加水稀释,溶液中[OH-]增大
C.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
一种澄清透明的溶液中,可能含有下列离子:K+、Fe3+、Ba2+、Al3+、NH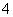 、Cl-、NO
、Cl-、NO 、HCO
、HCO 、SO
、SO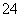 。现做以下实验:
。现做以下实验:
(1)将溶液滴在蓝色石蕊试纸上,试纸呈红色;
(2)取少量溶液,加入用稀HNO3酸化的BaCl2溶液,产生白色沉淀;
(3)将(2)中的沉淀过滤,向滤液中加入AgNO3溶液,产生白色沉淀;
(4)另取溶液,逐滴加入NaOH溶液至过量,只看到有红褐色沉淀生成,且沉淀质量不减少。
由此可以推断:
溶液中肯定存在的离子有_________________________________________________;
溶液中肯定不存在的离子有________________________________________________;
溶液中不能确定是否存在的离子有_________________________________________。
SO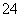 、Fe3+ Ba2+、Al3+、HCO
、Fe3+ Ba2+、Al3+、HCO K+、NH
K+、NH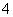 、Cl-、NO
、Cl-、NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com