
| A、NH4+、Ag+、NO3-、I- |
| B、Na+、K+、AlO2-、OH- |
| C、Ca2+、Fe2+、ClO-、Cl- |
| D、Mg2+、Al3+、CO32-、SO42- |


科目:高中化学 来源: 题型:
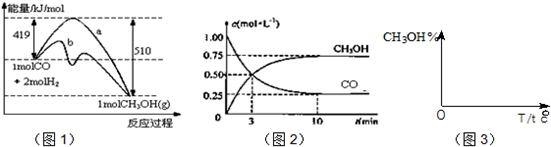
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一部分为Al(OH)3,一部分为Al3+ |
| B、全部为Al(OH)3 |
| C、一部分为Al(OH)3,一部分为AlO2- |
| D、全部为AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐酸浸泡 |
| 过滤 |
| 氧化处理 |
| 足量的 |
| NaOH溶液 |
| 过滤 |
| 洗涤 |
| 煅烧 |
| A、Al |
| B、Al(OH)3 |
| C、Al3+ |
| D、[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:
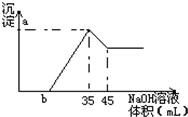 准确称取6g铝土矿(含Al2O3,Fe2O3,SiO2)样品,放入盛有100mLH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/LNaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.试求:
准确称取6g铝土矿(含Al2O3,Fe2O3,SiO2)样品,放入盛有100mLH2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/LNaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示.试求:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含a mol AlCl3的溶液和含1.5a mol NaOH的溶液,无论正滴和反滴,生成的Al(OH)3的质量相等 |
| B、含a mol Na2CO3的溶液和含1.5a mol HCl的稀盐酸,无论正滴和反滴,生成的CO2相等 |
| C、等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同 |
| D、二份质量相等组成不同的铝钠合金分别投入到足量盐酸中,若放出的H2越多,则铝的质量分数越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某气体通入FeCl2溶液中 | 溶液由浅绿色变为黄色 | 该气体中一定含有Cl2 |
| B | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体中一定含有SO2 |
| C | 将某气体通过灼热的CuO粉末 | 粉末由黑变红 | 该气体中一定含有H2 |
| D | 向某溶液中滴加NaOH溶液 | 先产生白色沉淀,后沉淀溶解 | 该溶液中一定含有Al3+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com