
【题目】下列各组物质中,第一种是混合物,第二种是盐,第三种是酸的是
A. 空气、硫酸铜、硫酸 B. 水、空气、纯碱
C. 食盐水、硝酸、烧碱 D. 氧化铁、胆矾、熟石灰
科目:高中化学 来源: 题型:
【题目】电解原理在工业中有广泛应用。如图是一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
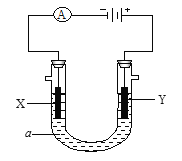
请回答以下问题:
(1) 若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式是: 。
在X极附近观察到的现象是: 。
②Y电极上的电极反应式是: ,
检验该电极反应产物的方法是: 。
(2) 如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是: ,电极反应式是: 。
②Y电极的材料是: ,电极反应式是: 。
(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方移式正确的是
A. 石英与烧碱溶液共热:SiO2+2OH-![]() SiO32-+H2O
SiO32-+H2O
B. 铜与稀硝酸反应:Cu+2H+=Cu2++H2↑
C. 在氢氧化钠溶液中通入过量CO2:2OH-+CO2=CO32-+H2O
D. 氯气通入KI溶液中:I-+Cl2=I2+Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,通电后,发现Cu极附近溶液蓝色加深。下列说法正确的是
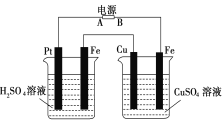
A.A极为负极,Cu为阳极
B.左烧杯溶液和右烧杯溶液的pH都变小
C.左烧杯Pt极和右烧杯Fe极的电解产物物质的量之比为1:1
D.左烧杯溶液浓度变大,右烧杯溶液浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-硫电池由于具有高比能量以及廉价易得等优势受到人们的广泛关注。锂-硫电池的正极材料主要由单质硫和一些高导电性材料复合而成,金属锂片作为负极,正负极之间用浸有电解液的隔膜隔开,其电池结构如图,下列说法不正确的是
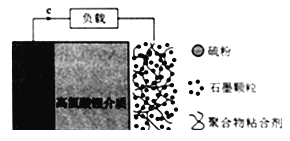
A. 负极的电极反应式为Li-e-=Li+
B. 正极材料中的石墨颗粒主要用于增强导电性
C. 总反应方程式为2Li+S=Li2s
D. 电池工作时电子经导线流向正极,又经高氯酸锂介质流向Li极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在下图装置中进行实验,向a中加入0.5 mol·L-1CuSO4溶液50mL和5 mol·L-1NaOH溶液100mL,振荡,再加入40%的甲醛溶液50mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。
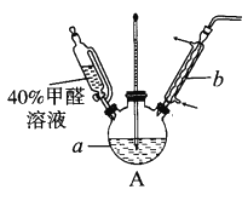
①仪器b的名称是___________,作用为__________。
②能说明甲醛具有还原性的实验现象是___________。
(2)查阅资料发现气体产物是副反应产生的。为确认气体产物中含H2不含CO,将装置A和如下图所示的装置连接后进行实验。
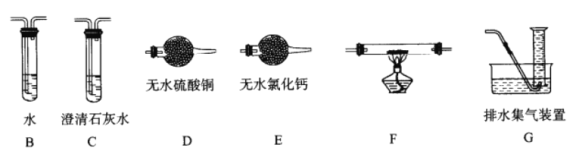
依次连接的合理顺序为A→B→___→___→___→___G,装置B的作用是_________。
(3)已知:![]() 。设计实验证明a中甲醛的碳元素未被氧化成+4价。_________________。
。设计实验证明a中甲醛的碳元素未被氧化成+4价。_________________。
(4)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应);
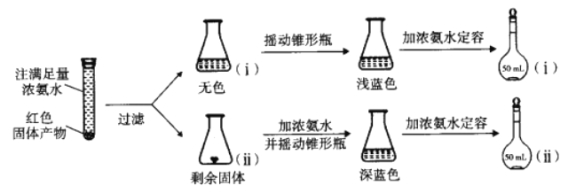
已知:Cu2O![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+](蓝色)。
[Cu(NH3)4]2+](蓝色)。
①摇动锥形瓶ⅰ的目的是_____________。
②锥形瓶ⅱ中固体完全溶解得深蓝色溶液的离子方程式为______________。
③将容量瓶ⅱ中的溶液稀释100倍后,溶液的颜色与容量瓶ⅰ相近。由此可知固体产物的组成及物质的量之比约为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B. 配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
C. 用分液的方法分离乙醇和水的混合溶液
D. 洗涤油污常用热的Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,根据表中的几种物质的电离平衡常数回答下列问题:
NH3·H2O | 2×10-5 |
HNO2 | 7×10-4 |
HClO | 3×10-8 |
H2CO3 | K1=4×10-7 K2=4×10-11 |
(1)常温下,等浓度的NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH![]() )较小,试分析原因: 。0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是 ,NO
)较小,试分析原因: 。0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是 ,NO![]() 水解反应的平衡常数Kh= mol·L-1(保留两位有效数字)。
水解反应的平衡常数Kh= mol·L-1(保留两位有效数字)。
(2)常温下,用氨水吸收CO2得到NH4HCO3溶液,其pH 7 (填“>”、“<”或“=”);反应NH3·H2O+H2CO3![]() NH
NH![]() +HCO
+HCO![]() +H2O的平衡常数K= 。
+H2O的平衡常数K= 。
(3) 少量CO2通入到过量的NaClO溶液中发生反应的离子方程式 :
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于常温下pH=2的醋酸溶液,下列叙述正确的是
A.c(H+)=c(CH3COO-)
B.加水稀释时![]() 增大
增大
C.与pH = 12的NaOH溶液等体积混合后,溶液呈中性
D.加入醋酸钠固体可抑制醋酸的电离,电离常数Ka变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com