
| A. | 2mol/L | B. | 1.5mol/L | C. | 1mol/L | D. | 0.5mol/L |
分析 还原性Fe2+>Br-,所以通入氯气先发生反应2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再发生反应2Br-+Cl2═Br2+2Cl-,氯气完全反应,Cl2的物质的量=$\frac{3.36L}{22.4L/mol}$=0.15mol,若Br-没有反应,则n(FeBr2)=0.5n(Br-)=0.15mol,0.15molFe2+只能消耗0.075mol的Cl2,故有部分Br-参加反应,设FeBr2的物质的量为x,则n(Fe2+)=x mol,n(Br-)=2x mol,未反应的n(Br-)=0.3 mol,参加反应的n(Br-)=(2x-0.3)mol,根据电子转移守恒列方程计算x值,再根据c=$\frac{n}{V}$计算.
解答 解:还原性Fe2+>Br-,所以通入氯气先发生反应2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再反应反应2Br-+Cl2═Br2+2Cl-,溶液中含有Br-,说明氯气完全反应,Cl2的物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,若Br-没有反应,则n(FeBr2)=0.5n(Br-)=0.15mol,0.15molFe2+只能消耗0.075mol的Cl2,故有部分Br-参加反应;
设FeBr2的物质的量为x,则n(Fe2+)=x mol,n(Br-)=2x mol,未反应的n(Br-)=0.3 mol,参加反应的n(Br-)=(2x-0.3)mol,根据电子转移守恒有x×1+[2x-0.3]×1=0.15mol×2,解得x=0.2 mol,所以原FeBr2溶液的物质的量浓度为$\frac{0.2mol}{0.1L}$=2mol/L.
故选:A.
点评 本题考查反应方程式的计算,难度中等,清楚还原性Fe2+>Br-,通入的Cl2首先氧化Fe2+,待Fe2+全部被氧化后才氧化Br-,判断Br-是否完全反应,是解题的关键


科目:高中化学 来源: 题型:选择题
| A. | 合金一定是多种金属的混合物 | B. | 合金的性能往往比纯金属优越 | ||
| C. | 合金的熔点一般比其组成金属低 | D. | 合金的硬度一般比其组成金属大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞试液变红的溶液中:Na+、HCO3-、NO3-、SiO32- | |
| B. | 某透明溶液中:Fe3+、K+、NO3-、Cl- | |
| C. | 某溶液中加入金属铝有氢气放出:K+、Ba2+、Cl-、SiO32- | |
| D. | 某无色溶液中:K+、Al3+、AlO2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 碱 | 盐 | 电解质 | 混合物 | |
| A | 纯碱 | 小苏打 | BaSO4 | 盐酸 |
| B | 烧碱 | 食盐 | NH3•H2O | CuSO4•5H2O |
| C | KOH | CaCO3 | 醋酸 | 水玻璃 |
| D | NH3 | Na2S | 明矾 | 磁性氧化铁 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
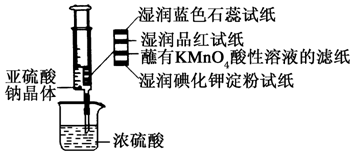 如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )| A. | 湿润的蓝色石蕊试纸先变红后褪色 | |
| B. | 湿润的品红试纸,蘸有KMnO4酸性溶液的滤纸均褪色证明了SO2的漂白性 | |
| C. | 湿润的碘化钾淀粉试纸未变蓝说明SO2氧化性强于I2 | |
| D. | 实验后,可把注射器中的物质推入NaOH溶液,以减少环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光照以后,所得混合气体中含有0.07 molHCl | |
| B. | 光照以后,所得混合气体体积小于原混合气体体积(相同条件下) | |
| C. | 最终所得溶液中,NaCl和NaClO的物质的量比为5:2 | |
| D. | 最终所得溶液中,还含有0.02 molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO | B. | Fe2O3 | C. | CuO | D. | Cu2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com