
| 应量取Na2CO3?10H2O的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器 |
| n |
| V |
| 应量取Na2CO3?10H2O的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器 |
| 14.3(2分) | 500(2分) | 烧杯、玻璃棒、胶头滴管(2分) |
| n |
| V |


科目:高中化学 来源: 题型:
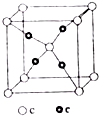 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度 | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
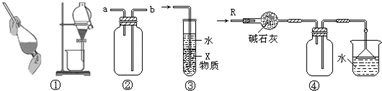
| A、装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
| B、装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 |
| C、装置①可用于分离乙醇和水的混合物 |
| D、装置④可用于干燥、收集氨气,并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入CaCO3悬浊液,CaCO3的溶解平衡向右移动 |
| B、加入澄清石灰水,c(H+)一定减小 |
| C、加入一定量NaOH溶液后,溶液中离子浓度的关系可能为c(Cl-)+c(ClO-)=c(Na+) |
| D、通入过量Cl2,①、②均向右移动,溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色溶液中可能大量存在 Al3+、NH4+、Cl-、S2- |
| B、酸性溶液中可能大量存在 Na+、ClO-、SO42-、I- |
| C、弱碱性溶液中可能大量存在 Na+、K+、Cl-、HCO3- |
| D、中性溶液中可能大量存在 Fe3+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
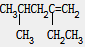 能跟氢气发生加成反应,其产物的名称为( )
能跟氢气发生加成反应,其产物的名称为( )| A、4-甲基-2-乙基戊烷 |
| B、3,5-二甲基己烷 |
| C、2-乙基-4-甲基戊烷 |
| D、2,4-二甲基己烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com