


科目:高中化学 来源: 题型:
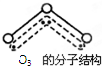 (1)根据要求完成下列问题:
(1)根据要求完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
- 2 |
- 3 |
2- 3 |
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| 甲 | 0.20 | 0.20 | pH=a |
| 乙 | 0.10 | 0.10 | pH=8.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
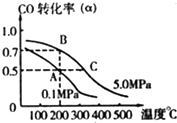 (1)金属铜与人体分泌物中的盐酸以及体内的空气反应可生成超氧酸:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示错误的是
(1)金属铜与人体分泌物中的盐酸以及体内的空气反应可生成超氧酸:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示错误的是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3>H2O>CH4 |
| B、CH4>NH3>H2O |
| C、CH4>H2O>NH3 |
| D、H2O>CH4>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇能够使蛋白质变性,可用于皮肤消毒 |
| B、Na的金属性比Mg强,可用Na与MgCl2溶液反应制取金属Mg |
| C、光照时乙烷和氯气能发生取代反应,工业上可用该反应生产氯乙烷 |
| D、碳酸钠溶液显碱性,用热的饱和碳酸钠溶液可除去金属表面的油污 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com