
【题目】X、Y、Z、W为原子序数递增的短周期主族元素,Y的简单气态氢化物水溶液呈弱碱性, Z元素无正价,且基态原子有2个未成对电子,基态W原子价层电子排布式为nsn-1npn-1 ,X与W为同主族元素。基态R原子M能层全充满且核外有且仅有1个未成对电子。请回答下列问题:
(1)基态R原子的核外电子排布式为____________________。R单质晶体晶胞的堆积方式_______________,晶胞的空间利用率为___________________。
(2) X、Y、Z三种元素的第一电离能由小到大的顺序为__________ (填“元素符号”,下同)
(3)YF3分子中Y的杂化类型为______________。该分子的空间构型为_________________。
(4)Y的气态氢化物在水中可形成氢键,其氢键最可能的形式为___________________。
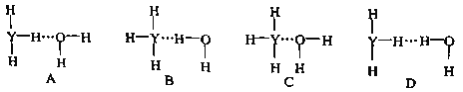
(5)X的某气态氧化物的相对分子质量为44,分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为_______________,其中σ键与π数目之比为______________。
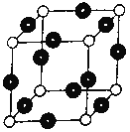
(6)R元素与Y元素形成某种化合物的晶胞结构如图所示(黑球代表R原子),若该晶体的密度为ρg·cm-3,则该晶胞的边长是_________cm (NA表示阿伏伽德罗常数的值)。
【答案】 ls22s22p63s23p63d104sl 面心立方最密堆积 74% C<O<N sp3 三角锥形 B Π![]() 1∶1
1∶1 
【解析】X、Y、Z、W为原子序数递增的短周期主族元素,Y的简单气态氢化物水溶液呈弱碱性,Y为N元素;Z元素无正价,且基态原子有2个未成对电子,Z为O元素;基态W原子价层电子排布式为nsn-1npn-1,则n=3,W为Si元素,X与W为同主族元素,则X为C元素;基态R原子M能层全充满且核外有且仅有1个未成对电子,价层电子排布为3d104s1,R为Cu元素。
(1)基态Cu原子的核外电子排布式为ls22s22p63s23p63d104sl。铜晶体晶胞的堆积方式为面心立方最密堆积,晶胞的空间利用率为74%,故答案为:ls22s22p63s23p63d104sl;面心立方最密堆积;74%;
(2)同一周期,从左到右,元素的第一电离能逐渐增大,但N原子的2p为半充满,均为稳定,第一电离能大于O,C、N、O三种元素的第一电离能由小到大的顺序为C<O<N,故答案为:C<O<N;
(3)NF3分子中N原子上有1个孤对电子,价层电子对数为4,采用sp3杂化,分子的空间构型为三角锥形,故答案为:sp3;三角锥形;
(4)氨气溶于水生成NH3·H2O,能够电离生成铵根离子和氢氧根离子,因此氨气在水中可形成氢键,其氢键最可能的形式为是氨气分子中N原子上的孤对电子与水分子中的H原子共用,形成氢键,故选B;
(5)C的某气态氧化物的相对分子质量为44,该氧化物为二氧化碳,分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则其气态氧化物中的大π键应表示为Π![]() ,二氧化碳分子中含有2个C=O,其中σ键与π数目之比为1:1,故答案为:Π
,二氧化碳分子中含有2个C=O,其中σ键与π数目之比为1:1,故答案为:Π![]() ;1∶1;
;1∶1;
(6)根据晶胞中微粒个数的分配方法计算,晶胞中含有N原子的数目为8×![]() =1,Cu原子的数目为:12×
=1,Cu原子的数目为:12×![]() =3,故化学式为Cu3N,1mol晶胞的质量为206g,所以该晶胞的边长=
=3,故化学式为Cu3N,1mol晶胞的质量为206g,所以该晶胞的边长=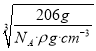 =
=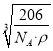 cm,故答案为:
cm,故答案为: 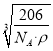 。
。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,下列叙述不正确的是
Z(g)+W(s) ΔH>0,下列叙述不正确的是
A. 在容器中加入氩气,反应速率不变
B. 加入少量W,逆反应速率不变
C. 升高温度,正反应速率增大,逆反应速率减小
D. 将容器的体积压缩,可增大单位体积内活化分子数,有效碰撞次数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
A.17g由H2S与PH3组成的混合气体中含有的质子数为9NA
B.90g果糖(C6H12O6,分子中无环状结构和碳碳双键)中含有的非极性键数目为3NA
C.1mol由乙醇与二甲醚(CH3-O-CH3)组成的混合物中含有的羟基数目为NA
D.已知![]() Ra→X+
Ra→X+![]() He,则0.5molX中含有的中子数为34NA
He,则0.5molX中含有的中子数为34NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在催化剂作用下,可逆反应2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)在温度为323K和343K时SiHCl2的转化率随时间变化的结果如图所示(已知:反应速率v=v正-v逆=k正![]() -k逆
-k逆![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数)。下列说法错误的是
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数)。下列说法错误的是

A.343K时,反应的平衡转化率为22%
B.343K时,反应的平衡常数约为0.02
C.323K时,提高反应物压强或浓度可缩短反应达到平衡的时间
D.a处的![]() 1.1,且a处的反应速率大于b处的反应速率
1.1,且a处的反应速率大于b处的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Fe3O4是一种非常重要的磁性材料,同时也可用作催化剂载体和微波吸收材料。納米级Fe3O4有多种不同制法,请回答下列相关问题。
I.下图是用共沉淀法制备纳米四氧化三铁的流程。
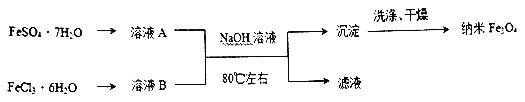
(1)除Fe3O4外铁的两种常见氧化物中在空气中性质比较稳定的是_______(填化学式),该物质的用途是___________(任写一种)。
(2)实验室保存溶液B 时为了防止出现浑浊通常采用的措施是___________ 。
(3)证明沉淀已经洗涤干净的操作是___________ 。
(4)写出该方法中发生的主要反应的离子方程式___________ 。
(5)实际生产中为提高产率,起始所用FeSO4·7H2O 和FeCl3·6H2O 的物质的量之比大于1:2,原因是___________。
II.制备纳米四氧化三铁的另一种流程如下图所示。
![]()
(6)写出第2 步反应的化学方程式______________,其中氧化产物和还原产物的物质的量之比为______。
(7)纳米Fe3O4投入分散剂中形成的分散系是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学降解法可用于治理水中硝酸盐的污染,电化学降解NO3-的原理如图所示,下列说法正确的是
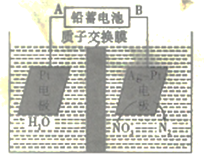
A.电源正极为B
B.H+由右侧通过交换膜移动到左侧
C.该电解池的阴极反应式为2NO3-+12H+ +10e-=N2↑+6H2O
D.标况下,若有2. 24LN2生成,理论上铅蓄电池中有20.7克Pb消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在合成氨工业和硝酸制备工业中,常产生N2O、NO和NO2等氮氧化物造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)在2L密闭容器中通入3mol H2和1mol N2,测得不同温度下,NH3的产率随时间的变化如图所示。
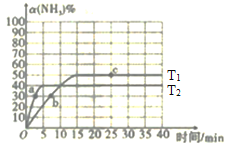
①下列有关说法正确的是________(填序号)。
A.a处的v正>0
B.e点的v净=0
C.由b点到c点混合气体相对分子质量逐渐增大
D.平衡时,通入氩气平衡正向移动
②T2温度时,0~5min内v(N2)=___mol·L-1·min-l
③已知:瞬时速率表达式v正=k正c3(H2)c(N2),v逆=k逆c2(NH3)(k为速率常数,只与温度有关)。温度由T1调到T2,活化分子百分率________。(填“增大”“减小”或“不变”),
k正增大倍数____k逆增大倍数(填“大于”“小于”或“等于”)。T1°C时,![]() ____
____
(2)工业生产尾气中产生的N2O需进行分解处理,用碘蒸气可大大提高N2O的分解速率,反应历程如下:
第一步:I2(g)=2I(g) (快反应)
第二步:I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步: IO(g)+N2O(g)→N2(g)+O2(g)+I(g) ( 快反应)
在反应过程中,I2的浓度与N2O分解速率_____ (填“有关”或“无关”);第___步反应对总反应速率起决定性作用;第二步的活化能比第三步____(填 “大”“小”或“相等”)。
(3)已除去N2O的硝酸尾气NO和NO2可用NaOH溶液吸收,写出NO和NO2与NaOH反应生成一种盐的反应方程式:_______;已知,常温下HNO2的电离常数Ka=5×10-4,则0.5mol/L对应钠盐的pH值为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从废定影液[含Ag(S2O3)23-和Br-等]中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉银,过滤、洗涤及干燥,灼烧Ag2S制Ag;制取Cl2并通入滤液氧化Br-,用苯萃取分液。其中部分操作的装置如图所示,下列叙述正确的是( )
A.用装置甲分离Ag2S时,用玻璃棒不断搅拌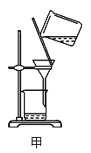
B.用装置乙在空气中高温灼烧Ag2S制取Ag
C.用装置丙制备用于氧化滤液中Br-的Cl2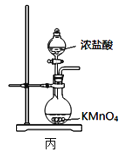
D.用装置丁分液时,先放出水相再放出有机相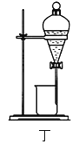
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用铜屑、硝酸和硫酸的混酸为原料制备硫酸铜晶体。结合具体操作过程回答下列问题。
(1)配制混酸:将3 mol/L的硫酸(密度1.180g/cm3)与15mol/L的浓硝酸(密度1.400 g/cm3)按体积比5:1混合后冷却。
①计算混酸中硫酸的质量分数为__________;
②取1g混酸,用水稀释至20.00mL,用0.5mol/L烧碱进行滴定,消耗标准烧碱溶液的体积为__________mL。
(2)灼烧废铜屑:称量一定质量表面含油污的纯铜屑(铜含量为99.84%),置于坩埚中灼烧,将油污充分氧化后除去,直至铜屑表面均呈黑色。冷却后称量,固体质量比灼烧前增加了3.2 %,
①固体中氧元素的质量分数为__________(保留3位小数);
②固体中铜与氧化铜的物质的量之比为___________。
(3)溶解:称取2.064g固体,慢慢分批加入一定质量的混酸,恰好完全反应。列式计算产生NO气体体积在标准状况下的体积(设硝酸的还原产物只有NO)。______________
(4)结晶:将反应后的溶液水浴加热浓缩后冷却结晶,析出胆矾晶体。
①计算反应后溶液中CuSO4的物质的量是__________;
②若最终得到胆矾晶体质量为6.400g,胆矾的产率为_________。(精确到1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com