

分析 (1)KClO3和草酸发生氧化还原反应生成ClO2、K2CO3、CO2和H2O,根据得失电子守恒、原子守恒书写方程式;
(2)二氧化氯(ClO2)沸点为11℃,用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,装置A必须添加温度控制装置,需温度计,ClO2温度过高可能引起爆炸,其温度要保持60-80℃之间,ClO2的沸点低,用冰水可以使ClO2冷凝为液体;
(3)用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等;
(4)溶液由蓝色恰好变为无色,且半分钟内不褪色,说明滴定至终点;
(5)根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2).
解答 解:(1)KClO3和草酸发生氧化还原反应生成ClO2、K2CO3、CO2和H2O,反应的化学方程式为:2KClO3+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$K2CO3+CO2↑+2ClO2↑+H2O,
故答案为:2KClO3+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$K2CO3+CO2↑+2ClO2↑+H2O;
(2)二氧化氯(ClO2)沸点为11℃,用氯酸钾粉末与草酸在60℃时反应可生成二氧化氯等物质,装置A必须添加温度控制装置,故装置A中还应安装的玻璃仪器是温度计;ClO2是一种黄红色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,温度过高可能引起爆炸,其温度要保持60-80℃之间,控制温度的目的是使反应发生(或正常进行),并防止温度过高引起爆炸,ClO2的沸点:11.0℃,沸点低,用冰水可以使ClO2冷凝为液体,收集在试管中或常温下二氧化氯为气态,
故答案为:温度计;使反应发生(或正常进行),并防止温度过高引起爆炸;冰水浴;
(3)装置中玻璃液封管的作用是,用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等.
故答案为:吸收残余的二氧化氯气体,并使锥形瓶内外压强相等;
(4)当滴入(最后)一滴标准液时,溶液由蓝色恰好变为无色,且半分钟内不褪色,说明滴定至终点,
故答案为:当滴入(最后)一滴标准液时,溶液由蓝色变为无色,且半分钟内不复原;
(5)VmLNa2S2O3溶液含有Na2S2O3物质的量为V•10-3 L×cmol/L=c•V•10-3 mol.则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) c•V•10-3 mol
所以n(ClO2)=$\frac{1}{5}$c•V•10-3 mol.
所以m(ClO2)=$\frac{1}{5}$c•V•10-3 mol×67.5g/mol=1.35cv×10-2g=0.0135 cvg,
故答案为:1.35cv×10-2或0.0135 cv.
点评 本题以氯及其化合物的性质考查氧化还原反应及物质的制备实验,把握习题中的信息及知识迁移应用为解答的关键,侧重学生综合应用能力及信息抽取和分析能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 鸡蛋清溶于水所得澄清液体无丁达尔现象 | |
| B. | 棉、麻、丝、毛完全燃烧都只生成CO2和H2O | |
| C. | 中国瓷器闻名世界,陶瓷的主要成分是SiO2 | |
| D. | 人体内的酶通常通过降低反应的活化能来加快对应反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 吗替麦考酚酯的分子式为C23H30O7N | |
| B. | 吗替麦考酚酯可发生加成、取代、消去反应 | |
| C. | 吗替麦考酚酯分子中所有碳原子一定处于同一平面 | |
| D. | 1mol吗替麦考酚酯与NaOH溶液充分反应最多消耗3mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
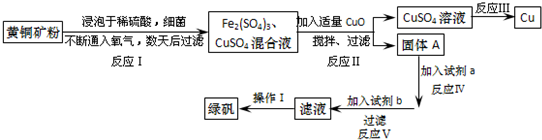
| Fe2+ | Cu2+ | Fe3+ | |
| 开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
| 完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
实验序号 | 反应温度/℃ | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/ml | c/(mol•L-1) | V/ml | c/(mol•L-1) | V/ml | ||
| A | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 5 | 0.1 | 5 | 0.1 | 10 |
| 预测 | 实验操作 | 实验现象 | ?现象解释 | |
| 探究① | Na2S2O3溶液呈碱性 | 溶液pH=8 | S2O32-+H2O HS2O3-+OH- | |
| 探究② | Na2S2O3有还原性 | 向新制氯水中滴加Na2S2O3溶液 | 氯水颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下加水稀释时c(H+)/c(OH-)明显增大的溶液:CH3COO-、Ba2+、NO3-、Br- | |
| B. | pH=1的溶液中:Na+、Fe2+、NO3-、SO42- | |
| C. | 由水电离的c(OH-)=10-13mol•L-1的溶液中:Na+、Cl-、CO32-、NO3- | |
| D. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 实验室测定常温下l molH2的体积通常用如图所示的装置.
实验室测定常温下l molH2的体积通常用如图所示的装置.| 实验次数 | 镁带质量(g) | 硫酸体积( mL) | 氢气体积( mL) | l摩尔气体的体积(L)(精确到0.001L) |
| 1 | 0.050 | 10 | 49.0 | |
| 2 | 0.049 | 10 | 48.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X、Y与Z的原子半径大小:Y>Z>X | |
| B. | 元素W、Z的氯化物中,化学键类型相同,且各原子均满足8电子 | |
| C. | 元素X与元素Y形成的化合物是一种较好的耐火材料 | |
| D. | 元素X可与元素Z可组成3种二价阴离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com