
A��B��C��X��Ϊ��ѧ�����Ĵ��������֮��������ת����ϵ������������ȥ����
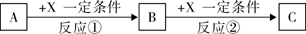
�ش��������⣺
��1����A�Ƿǽ������ʣ�X��ǿ�����Ե��ʣ�C��ˮ��Ӧ�����ᡣ��X������������A����������������
��2����A��ǿ�ᣬX�ǽ������ʣ���C��ˮ��Һ�еμ�BaCl2��Һ��������������A������������X������������
��3����A��һ������ʯ����Ӧ�ٺ͢ڶ��ǹ�ҵ�����������е���Ҫ��Ӧ��C��ˮ��Ӧ����ǿ��D����ҵ�����з�Ӧ�ٷ������豸����������������ͭ��D��һ�������·�����Ӧ�ķ���ʽ������������
��1��O2��1�֣�����C��S��N2����1�֣�д��һ�ּ��ɣ�
��2��HNO3��1�֣���Fe��1�֣���
��3������¯��1�֣���Cu+2H2SO4 CuSO4+SO2��+2H2O ��2�֣���
CuSO4+SO2��+2H2O ��2�֣���
����������1�����A�Ƿǽ����������������Ӧ����S��������Ӧ����SO2��SO2������������Ӧ������������������������ˮ�������ᡣ������C��CO��CO2��H2CO3��N2��NO��NO2��HNO3��
��2�����X�ǽ�������Ӧ���DZ�۵Ľ���Ԫ�أ�����������C��ˮ��Һ�еμ�BaCl2��Һ��������������A�����ᣬ������Ũ���ᡣ
��3������ʯ�������������ᣬ���Է�Ӧ�����豸�Ƿ���¯��ͭŨ���ᷴӦ�ķ���ʽΪCu+2H2SO4 CuSO4+SO2��+2H2O��
CuSO4+SO2��+2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ���� |
| �� |
| ���� |
| �� |


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
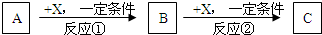
 ����3�ֻ�����A��B��C����������Ԫ��R����ת����ϵ��ͼ��ʾ��
����3�ֻ�����A��B��C����������Ԫ��R����ת����ϵ��ͼ��ʾ��

| ||
| �� |
| ||
| �� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com