
【题目】Ⅰ.氢气用于工业合成氨 N2(g) + 3H2(g) ![]() 2NH3(g);ΔH = -92.2 kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t5 ﹑t7时刻所对应的实验条件改变分别是
2NH3(g);ΔH = -92.2 kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t5 ﹑t7时刻所对应的实验条件改变分别是
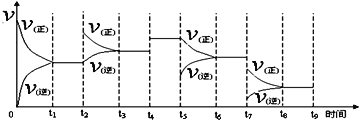
t5 ___________________。t7___________________。
Ⅱ.已知化学反应①:Fe(s)+CO2(g) ![]() FeO(s)+CO(g), 其平衡常数为K1;
FeO(s)+CO(g), 其平衡常数为K1;
化学反应②:Fe(s)+H2O(g) ![]() FeO(s)+H2(g),其平衡常数为K2。
FeO(s)+H2(g),其平衡常数为K2。
在温度973K和1173K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
(1)1173K时,若c(CO2)=2mol/L,c(CO) =5mol/L,则此时反应①平衡向__________(填“正”或“逆”)反应方向移动。
(2)现有反应③CO2(g)+H2(g) ![]() CO(g)+H2O(g),写出该反应的平衡常数K3的表达式:K3=_______________________(用K1 、 K2表示)。据此关系式及上表数据,能推断出反应③是______(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是______(填写序号)。
CO(g)+H2O(g),写出该反应的平衡常数K3的表达式:K3=_______________________(用K1 、 K2表示)。据此关系式及上表数据,能推断出反应③是______(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是______(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
能判断反应③已达平衡状态的是_______________________________。
A.恒容容器中压强不变 B.混合气体中c(CO)不变
C.![]() (H2)==
(H2)==![]() (H2O) D.c(CO2)==c(CO)
(H2O) D.c(CO2)==c(CO)
(3)723K时,0.2molCO2和0.1molH2通入抽空的1L恒容密闭容器中,发生反应③,达到平衡后水的物质的量分数为0.1。则H2的转化率α(H2)=___________%。723K该反应的平衡常数为K=________________。(结果保留两位有效数字)
【答案】t5 减少NH3浓度 t7 降低温度 逆 K3=![]() 吸热 DF BC 30% 0.076
吸热 DF BC 30% 0.076
【解析】
I.根据图像中正逆反应速率的变化确定移动方向;
II.(1)根据Qc与K1的关系确定平衡移动方向;
(2)根据方程式确定K3=![]() ;计算K3,确定正反应为吸热反应;
;计算K3,确定正反应为吸热反应;
(3)根据方程式列出关系进行计算。
I. t5时,正反应速率未变,逆反应速率减小,则改变的外界条件为减小生成物的浓度;t7时,正逆反应速率均减小,且反应正向进行,若为减小压强,体积增大平衡逆向移动,与题意不符,若为降低温度,平衡向放热的方向移动,已知正反应为放热,则正向移动,符合题意;
II.(1)1173K时,Qc= c(CO)/c(CO2)=5/2=2.5> K1=2.15,则平衡逆反应方向移动;
(2)根据方程式,K3=![]() ,K1=
,K1=![]() ,K2=
,K2=![]() ,则K3=
,则K3=![]() ;973K时,K3=1.47/2.38=0.62,1173K时,K3=2.15/1.67=1.29,升高温度,K值增大,平衡正向移动,则正反应为吸热反应;
;973K时,K3=1.47/2.38=0.62,1173K时,K3=2.15/1.67=1.29,升高温度,K值增大,平衡正向移动,则正反应为吸热反应;
A.可逆号两边气体计量数相同,缩小反应容器容积,平衡不移动,与题意不符,A错误;
B.可逆号两边气体计量数相同,扩大反应容器容积,平衡不移动,与题意不符,B错误;
C.反应为吸热反应,根据勒夏特列原理,降低温度,平衡向放热的方向移动,即逆反应方向,与题意不符,C错误;
D.反应为吸热反应,根据勒夏特列原理,升高温度,平衡向吸热的方向移动,即正反应方向,符合题意,D正确;
E.使用合适的催化剂,可提高反应速率,对化学平衡无影响,与题意不符,E错误;
F.设法减少CO的量,CO为生成物,则平衡正向移动,符合题意,F正确;
答案为DF;
A.可逆号两边气体计量数相等,反应自始至终,容器内的气体物质的量一直未变,容积为恒容,则恒容容器中压强一直不变,压强不能作为判断是否平衡的依据,A错误;
B.反应达到平衡状态时,体系中各气体的浓度不再改变,混合气体中c(CO)不变时,达到平衡状态,B正确;
C.![]() (H2)、
(H2)、![]() (H2O) 反应方向相反,物质的量之比等于计量数之比,则可判断达到平衡状态,C正确;
(H2O) 反应方向相反,物质的量之比等于计量数之比,则可判断达到平衡状态,C正确;
D.c(CO2)==c(CO)时,不能判断是否达到平衡状态,D错误;
答案为BC;
(3)CO2(g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
初始:0.2 0.1
反应:x x x x
平衡:0.2-x 0.1-x x x
x/(0.2-x+0.1-x+x+x)=0.1,则x=0.03mol,α(H2)=![]() ×100%=30%;723K时,c(CO2)=0.17mol/L,c(H2)=0.07mol/L,c(CO)=0.03mol/L,c(H2O)=0.03mol/L,K=
×100%=30%;723K时,c(CO2)=0.17mol/L,c(H2)=0.07mol/L,c(CO)=0.03mol/L,c(H2O)=0.03mol/L,K=![]() =0.076。
=0.076。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g),起始时SO2和O2分别为20 mol和10 mol,达到平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为( )
2SO3(g),起始时SO2和O2分别为20 mol和10 mol,达到平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为( )
A. 10mol和10%B. 20mol和20%C. 20mol和40%D. 30mol和80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Al2O3样品中含有一定量的Cu、Fe、Fe2O3杂质。现通过下列生产过程,从该样品中回收铁红。流程如下:

(1)操作a是________,在实验室进行该操作需要的玻璃仪器有烧杯、漏斗和_______。
(2)试剂①是_______,固体II是_________(填化学式)。
(3)红褐色沉淀的成分是_________;写出白色沉淀转化为红褐色沉淀的化学方程式:______________。
(4)溶液II中铁元素的存在形式是_______(填离子符号),如何用实验证明:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 铝粉投入NaOH溶液中:2Al+2OH-===2AlO2-+H2↑
B. Na与CuSO4溶液反应:Cu2++2Na===2Na++Cu
C. 向AlCl3溶液中加入足量的氨水:Al3++3OH-===Al(OH)3↓
D. Ba(OH)2溶液与稀硫酸反应:Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子中,VSEPR(价层电子对互斥理论)模型名称与分子或离子的空间构型名称不一致的是
A.CO2B.CO32-C.H2OD.CC14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.56gCu和200mL某浓度的浓HNO3混合,随着反应的进行生成气体的颜色逐渐变浅,当Cu反应完全时,共收集到气体1.12L(标准状况)。
下列关于该反应的分析错误的是( )
A.该反应生成的NO2与NO的体积比为7 : 3
B.该反应转移电子数为0.04NA
C.该反应消耗HNO3的物质的量为0.13mol
D.反应结束后所得溶液中(忽略反应前后溶液体积的变化)c(NO3-) = 0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有如下3个热化学方程式:H2(g)+![]() O2(g)= H2O(g) △H=a kJ/mol,H2(g)+
O2(g)= H2O(g) △H=a kJ/mol,H2(g)+ ![]() O2(g)= H2O(l) △H=b kJ/mol,2H2(g) +
O2(g)= H2O(l) △H=b kJ/mol,2H2(g) + ![]() O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
A.它们都是吸热反应B.a、b、c均为正值C.a=bD.c=2b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,从A处通入新制备的Cl2,关闭B阀时,C处的红色布条看不到明显现象;当打开B阀后,C处红色布条逐渐褪色。D瓶中装的是( )

①浓硫酸 ②NaOH溶液 ③H2O ④饱和NaCl溶液
A. ①③ B. ②④ C. ①② D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对二乙烯苯(如图)可用作树脂、油漆及特种橡胶的原料。下列说法正确的是
![]()
A.分子中所有原子可能共平面B.易溶于甲苯,沸点比甲苯低
C.不能使稀酸性高锰酸钾溶液褪色D.1 mol该物质至多可与2 mol H2加成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com