
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ③⑤⑥ | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 其他条件不变,使用不同催化剂,该反应的平衡常数不变 | |
| C. | 平衡时,其他条件不变,升高温度可提高SO2的转化率 | |
| D. | 平衡时,其他条件不变,分离出硫,正反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将容器体积变为原来一半 | B. | 压强变为原来一半 | ||
| C. | 加入2n molCO,2n molH2O | D. | 加入2n molCO2和2n molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向苯酚钠溶液中滴入NaHSO3溶液,出现白色浑浊 | C6H5O-结合质子的能力比SO32-强 |
| B | 向待测液X中依次滴入氯水、KSCN溶液,溶液变红 | 待测液X中一定含有Fe2+ |
| C | 向(NH4)2S2O8溶液中加入硝酸酸化的Mn(NO3)2溶液和1滴AgNO3溶液(作催化剂),微热,溶液变紫色 | S2O82-氧化性比MnO4-强 |
| D | 浓硫酸与乙醇共热产生的气体Y,通入酸性KMnO4溶液,溶液紫色褪去 | 气体Y为纯净的乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
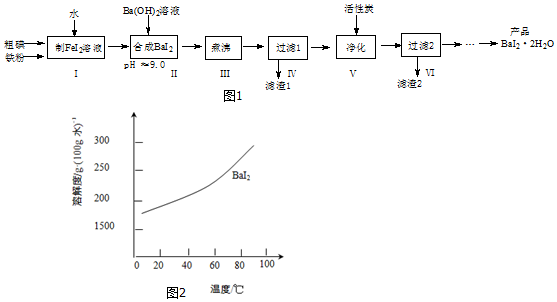
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
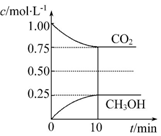
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4 g镁在足量的O2中燃烧,转移的电子数为0.1 NA | |
| B. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2 NA | |
| C. | 1 L一氧化碳气体一定比1 L氧气的质量小 | |
| D. | 常温常压下,8 g O3中含有8 NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com