
����Ŀ���״���һ����Ҫ�Ļ���ԭ�Ϻ�����ȼ�ϡ�
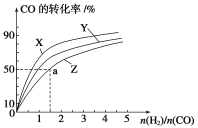
(1)��ҵ��һ����CO��H2Ϊԭ�����ܱ������кϳɼ״���CO(g)��2H2(g)![]() CH3OH(g)����H����90.8 kJ��mol��1�����ݻ�Ϊ1 L�ĺ��������У��ֱ��о���230 ����250 ����270 �������¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶���H2��CO����ʼ��ɱ�(��ʼʱCO�����ʵ�����Ϊ1 mol)��COƽ��ת���ʵĹ�ϵ��������Z��Ӧ���¶���________�����¶���������Ӧ�Ļ�ѧƽ�ⳣ��Ϊ________��
CH3OH(g)����H����90.8 kJ��mol��1�����ݻ�Ϊ1 L�ĺ��������У��ֱ��о���230 ����250 ����270 �������¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶���H2��CO����ʼ��ɱ�(��ʼʱCO�����ʵ�����Ϊ1 mol)��COƽ��ת���ʵĹ�ϵ��������Z��Ӧ���¶���________�����¶���������Ӧ�Ļ�ѧƽ�ⳣ��Ϊ________��
(2)��ͼ�Ǽ״�ȼ�ϵ�ع�����ʾ��ͼ������A��B��D��Ϊʯī�缫��CΪͭ�缫������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ��

I.���и����ĵ缫��ӦʽΪ_________ _______
II�����з�Ӧ�Ļ�ѧ����ʽΪ______ __ ________��A�������������ڱ�״���µ����Ϊ________________��
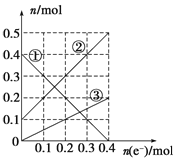
III����װ����Һ�н��������ӵ����ʵ�����ת�Ƶ��ӵ����ʵ����仯��ϵ����ͼ����ͼ�Т��߱�ʾ����________�ı仯����Ӧ������Ҫʹ��װ���н���������ǡ����ȫ��������Ҫ________ mL 5.0 mol��L��1 NaOH��Һ��
���𰸡�
��1��270 �棻4��
��2����.CH3OH��6e����8OH��===CO��6H2O
��. 2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4��2H2O
2Cu+O2��+2H2SO4��2H2O![]() O2��+2H2����2.24 L��
O2��+2H2����2.24 L��
III��Fe2����280
��������
�����������1�����ݸ÷�ӦΪ���ȷ�Ӧ���¶�Խ��CO��ת����ԽС����������ZΪ270����
��ͼ���֪��270��ʱ��CO��ת����Ϊ50%��n��H2����n��CO��=1.5����
CO��g��+2H2��g��CH3OH(g)
��ʼ��mol/L�� 1 1.5 0
ת����mol/L�� 0.5 1 0.5
ƽ�⣨mol/L�� 0.5 0.5 0.5
K=![]() =
=![]() =4��
=4��
�ʴ�Ϊ��270����4��
��2�������״�ȼ�ϵ����ԭ��ط�Ӧ���״��ڸ���ʧ���ӷ���������Ӧ���缫��ӦΪ��
CH3OH-6e-+8OH-=CO32-+6H2O��
�ʴ�Ϊ��CH3OH-6e-+8OH-=CO32-+6H2O��
���������ڵ��װ�ã�AΪ������BΪ��������ʼʱ��ⷴӦ�Ļ�ѧ����ʽΪ��2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4��һ��ʱ���ͭ����ȫ���μӷ�Ӧ��ⷽ��ʽΪ��2H2O
2Cu+O2��+2H2SO4��һ��ʱ���ͭ����ȫ���μӷ�Ӧ��ⷽ��ʽΪ��2H2O![]() O2��+2H2��������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ�������缫��Ӧ��BΪ��������Һ��ͭ���������������ӵõ����������������������������ʵ���ΪX����Һ��ͭ�������ʵ���Ϊ0.1mol���缫��ӦΪ��
O2��+2H2��������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ�������缫��Ӧ��BΪ��������Һ��ͭ���������������ӵõ����������������������������ʵ���ΪX����Һ��ͭ�������ʵ���Ϊ0.1mol���缫��ӦΪ��
Cu2++ 2e-=Cu��
0.1mol 0.2mol
2H++2e-=H2����
2x x
A�缫Ϊ��������Һ�е�����������ʧ���������������缫��ӦΪ��
4OH--4e-=2H2O+O2����
4x x
���ݵ�ʧ�����غ�õ�0.2+2x=4x��
x=0.1mol
����A�����������������������ʵ���Ϊ0.1mol���ڱ�״���µ����Ϊ2.24L��
�ʴ�Ϊ��2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4��2H2O
2Cu+O2��+2H2SO4��2H2O![]() O2��+2H2����2.24L��
O2��+2H2����2.24L��
��������ת�Ƶ��ӵ����ʵ����ͽ��������ӵ����ʵ����ı仯����֪��ͭ���Ӵ������࣬���������ʵ�����С�������������ӣ�����ΪFe3+����ΪFe2+����ΪCu2+����ͼ��֪����ת��Ϊ0.4mol������Cu2+���ʵ���Ϊ0.2mol�������缫��ӦFe3++e-=Fe2+����Ӧ��������Һ����Fe2+Ϊ0.5mol��Cu2+Ϊ0.2mol��������Ҫ����NaOH��Һ0.5��2+0.2��2=1.4mol����������NaOH��Һ�����Ϊ1.4/5=0.28L=280mL��
�ʴ�Ϊ��Fe2+��280


 ���ٴ�����ɽ����ϵ�д�
���ٴ�����ɽ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��Һ��ֻ���ܺ������������е������֣�����ˮ���������H����OH������H+��NH4����K����Mg2����Fe3+��Al3����NO3һ��CO32һ��SO42������ȡ����100 mL��Һ��������ʵ�飺
�� ��һ�ݼ�����AgNO3��Һ���а�ɫ����������
�� �ڶ��ݼ�����BaCl2��Һ���а�ɫ������������ϴ�ӡ������������Ϊ4.66 g��
�� ��������εμ�NaOH��Һ����ó�����NaOH��Һ�������ϵ����ͼ��
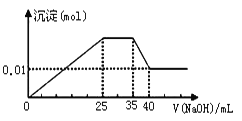
��������ʵ�飬�����Ʋ�����ȷ������ ��
A�����ݵ���غ㣬ԭ��Һ��NO3�������ʵ���ӦΪ0.03 mol
B��ԭ��Һһ��������H����Fe3����CO32��
C��ԭ��Һȷ����Mg2����Al3����NH4������n(Mg2��)��n(Al3��)��n( NH4��) = 1��1��2
D��ʵ�����ӵ�NaOH��Ũ��Ϊ2 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����( )
A���ơ��̡����Ⱦ��ܲ������������
B���������ܡ�̫���ܡ����ܡ��������ܵ�������Դ�Ǽ��е�̼�������Ч;��
C�����⻯ѧ�������������������ꡱ���γɶ��뵪���������й�
D������������ú����ԭú��ȼ�Ͽ�����Ч���ٿ�����CO2����ĺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������������ȡ��������(��Ҫ�ɷ�ΪFe2O3��SiO2��Al2O3����������������)��ȡ��ˮ����������(FeSO4��7H2O)��������������̣�����˵������ȷ����
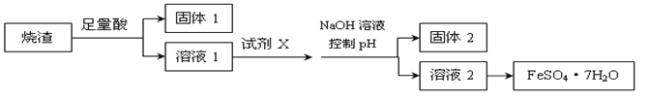
A���ܽ�����ѡ���������ᣬ�Լ�Xѡ������
B������1��һ������SiO2������pH��Ϊ��ʹAl3+ת��ΪAl(OH)3���������2
C������Һ2�õ�FeSO4��7H2O��Ʒ�Ĺ����У������������ֹ�������ͷֽ�
D�����ı䷽��������Һ1��ֱ�Ӽ�NaOH���������õ��ij����������ܽ⣬����Һ���ᾧ����Ҳ�ɵõ�FeSO4��7H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2H��H2�ų�437.6 kJ������������˵����ȷ���ǣ� ��
A������������ÿ����ԭ�Ӷ��ﵽ��8�����ȶ��ṹ
B��1 mol H2��������2 mol H��������
C��1 mol H2����2 mol HҪ�ų�437.6 kJ����
D����ԭ�Ӳ�������ӻ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ǿ��˳��ΪH2CO3��![]() ��HCO3�������л�ѧ����ʽ��ȷ���ǣ� ��
��HCO3�������л�ѧ����ʽ��ȷ���ǣ� ��
A��![]() +H2O+CO2��
+H2O+CO2��![]() +NaHCO3
+NaHCO3
B��2![]() +H2O+CO2��2
+H2O+CO2��2![]() +Na2CO3
+Na2CO3
C��![]() +Na2CO3��
+Na2CO3��![]() +H2CO3
+H2CO3
D��![]() +Na2CO3��
+Na2CO3��![]() +NaHCO3
+NaHCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�ϵͼ�У�A��һ�����Σ�B����̬�⻯�C�ǵ��ʣ�F��ǿ�ᡣ��X������ǿ�ỹ��ǿ��ʱ��������ת����ϵ��������Ӧ���P��Ӧ��������������ȥ������X��ǿ��ʱ��������B��Cl2��Ӧ������C�⣬��һ�����������Ρ�
![]()
����˵���в���ȷ������ ��
A����X��ǿ��ʱ��A��B��C��D��E��F�о���ͬһ��Ԫ�أ�F������H2SO4
B����X��ǿ��ʱ��A��B��C��D��E��F�о���ͬһ��Ԫ�أ�F��HNO3
C��B��Cl2�ķ�Ӧ��������ԭ��Ӧ
D����X��ǿ��ʱ��C�ڳ���������̬����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У����ʽ��ͬ�����Ȳ���ͬϵ��ֲ���ͬ���칹�����
A����ϩ�������� B����ȩ���������
C����ϩ��1����ϩ D�����ᡢ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����ϡ�����ͻ���������ء������й�˵���д�����ǣ� ��
A��ij���ͺ����������Ҫ�ɷ�����̼���衢�մɺ�̼��ά���϶��ɣ�����һ���������ǽ�������
B�������Ʒ����Ҫ�ɷ��뽨������ɰ����ͬ
C��������ˮʱ�����˻�ѧ�������仯������ˮ���ã���û��ɱ��������������
D��ҽ�þƾ����������Ҵ�����������ɱ��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com