
 已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):
已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去): ;D
;D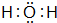 .
.分析 (1)10电子微粒A、B反应得到两种10电子微粒,应是铵根离子与氢氧根离子反应得到氨气与水,而C、B都能与氢离子反应,可推知A为NH4+,B为OH-,C为NH3,D为H2O;
(2)如果A、C均是18电子的粒子,B、D是10电子粒子,结合转化关系,可推断:A为H2S,B为OH-,C为HS-或S2-,D为H2O.
解答 解:(1)10电子微粒A、B反应得到两种10电子微粒,应是铵根离子与氢氧根离子反应得到氨气与水,而C、B都能与氢离子反应,可推知A为NH4+,B为OH-,C为NH3,D为H2O,NH4+的电子式为 ,H2O的电子式为
,H2O的电子式为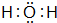 ,
,
故答案为: ;
;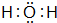 ;
;
(2)如果A、C均是18电子的粒子,B、D是10电子粒子,结合转化关系,可推断:A为H2S,B为OH-,C为HS-或S2-,D为H2O,A与B在溶液中反应的离子方程式为:HS-+OH-═S2-+H2O,根据离子方程式,可以判断结合质子的能力大小是OH->S2-,
故答案为:HS-+OH-═S2-+H2O;OH->S2-.
点评 本题考查无机物推断,熟练掌握常见10电子、18电子微粒的结构和性质应用,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸钠 氢氧化钠 | B. | 氧化铜 二氧化锰 | ||
| C. | 氯化钾 碳酸钙 | D. | 硫酸铜 氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| B. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 | |
| C. | 将稀硝酸加入过量铁粉中,充分反应后滴加硫氰化钾溶液,有气体生成溶液呈血红色,说明稀硝酸将铁氧化为正三价铁离子 | |
| D. | 用坩埚钳夹住一小块用砂纸打磨过的铝箔在酒精灯上加热,熔化后的液态铝不会滴落 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,很多不饱和有机物在E催化下可与H2加成反应:
,很多不饱和有机物在E催化下可与H2加成反应:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解中溶液pH随时间t变化的曲线如图,则下列说法正确的是( )
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解中溶液pH随时间t变化的曲线如图,则下列说法正确的是( )| A. | 阳极产物一定是Cl2,阴极产物一定是Cu | |
| B. | BC段表示在阴极上是H+放电产生了H2 | |
| C. | CD段表示电解水 | |
| D. | CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g${\;}_{6}^{14}$C中含有的质子数为14NA | |
| B. | 1mol苯乙酸中所含碳碳双键数为4NA | |
| C. | 1L 2mol/L的NaClO水溶液中含有的氧原子数为2NA | |
| D. | 标准状况下,3.36L NO2和足量水充分反应转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:选择题
利用反应2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH=-746.8 kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
2CO2(g)+N2(g) ΔH=-746.8 kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
A.降低温度 B.升高温度同时充入N2
C.增大压强同时加催化剂 D.及时将CO2和N2从反应体系中移走
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com