
根据下列热化学方程式分析,C(s)的燃烧热△H等于()
C(s)+H2O(l)=CO(g)+H2(g);△H1=+175.3kJ•mol﹣1
2CO(g)+O2(g)=CO2(g);△H2=﹣566.0kJ•mol﹣1
2H2(g)+O2(g)=2H2O(l);△H3=﹣571.6kJ•mol﹣1.
A. △H1+△H2﹣△H3 B. 2△H1+△H2+△H3
C. △H1+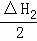 +△H3 D. △H1+
+△H3 D. △H1+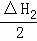 +
+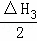
考点: 用盖斯定律进行有关反应热的计算.
专题: 化学反应中的能量变化.
分析: 燃烧热是1mol可燃物质完全燃烧生成稳定氧化物放出的热量,根据盖斯定律来回答.
解答: 解:已知:①C(s)+H2O(l)=CO(g)+H2(g);△H1=+175.3kJ•mol﹣1
②2CO(g)+O2(g)=CO2(g);△H2=﹣566.0kJ•mol﹣1
③2H2(g)+O2(g)=2H2O(l);△H3=﹣571.6kJ•mol﹣1
则化学方程式C(s)+O2(g)=CO2(g)可以看成是×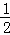 得到的,所以该反应的焓变△H=△H1+
得到的,所以该反应的焓变△H=△H1+ ,即为C(s)的燃烧热.
,即为C(s)的燃烧热.
故选D.
点评: 本题考查学生燃烧热的概念以及盖斯定律的应用知识,注意知识的迁移和应用是关键,难度不大.


科目:高中化学 来源: 题型:
把下列四种X溶液分别加入四个盛有10mL 2mol/L的盐酸的烧杯中,同时加水稀释到50mL,此时X和盐酸缓慢反应.其中反应速率最大的是()
A. 10℃20mL3mol/L的X溶液 B. 20℃30mL2mol/L的X溶液
C. 20℃10mL4mol/L的X溶液 D. 10℃10mL2mol/L的X溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 生成物的总能量一定低于反应物的总能量
B. 分解反应一定是吸热反应
C. 应用盖斯定律,可计算某些难以直接测量的反应的焓变
D. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一.请回答钢铁在腐蚀、防护过程中的有关问题.
(1)图1哪个装置可防止铁棒被腐蚀BD.
(2)在实际生产中,可在铁 件的表面镀铜防止铁被腐蚀.装置示意图如图2. 请回答
件的表面镀铜防止铁被腐蚀.装置示意图如图2. 请回答
①A电极对应的金属是铜(写元素名称),B电极的电极反应式是 .
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因 .
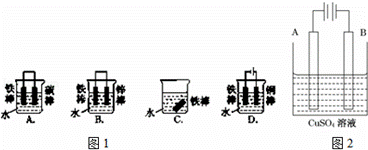
查看答案和解析>>
科目:高中化学 来源: 题型:
关于热化学方程式:2H2(g)+02(g)=2H20(1),△H=﹣571.6kJ•mol﹣1,下列有关叙述不正确的是()
A. 2mol H2完全燃烧生成液态水时放出571.6 kJ的热
B. 1mol H2完全燃烧生成液态水时放出285.8kJ的热
C. 2个氢分子完全燃烧生成液态水时放出571.6 kJ的热
D. 上述热化学方程式可表示为H2(g)+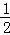 O2(g)=H20(1),△H=﹣285.8 kJ•mol﹣1
O2(g)=H20(1),△H=﹣285.8 kJ•mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于反应热的说法正确的是()
A. 当△H<0时,表示该反应为吸热反应
B. 已知C(s)+ O2(g)=CO(g)△H=﹣110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol
O2(g)=CO(g)△H=﹣110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol
C. 反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D. 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
查看答案和解析>>
科目:高中化学 来源: 题型:
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为 .
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2 (g)+Cl2 (g)=2HCl (g)△H=﹣185kJ/molE(H﹣H)=436kJ/mol E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+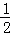 O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
C(s)+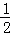 O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJ•mol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为 .
(4)①如图是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为: .
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为 ;若在同体积的容器中充入2mol N2和6mol H2,达平衡后放出的热量为Q2 kJ,则Q2 2Q1(填“>”、“<”或“=”)

查看答案和解析>>
科目:高中化学 来源: 题型:
非金属溴与氯气的性质很相似.在探究溴单质的性质时,其基本程序应该是()
A. 做实验并观察实验现象→分析、解释,得出结论
B. 观察溴的外观性质→做实验并观察实验现象→分析、 解释,得出结论
解释,得出结论
C. 观察溴的外观性质→预测溴的化学性质→做实验并观察实验现象→分析、解释,得出结论
D. 预测溴的性质→做实验并观察实验现象→分析、解释,得出结论 →观察溴的外观性质
→观察溴的外观性质
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如图:
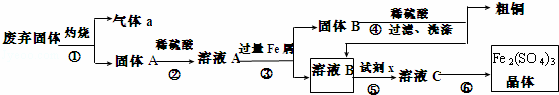
(1)除酒精灯和铁架台或三脚架外,①中所需的容器和夹持仪器分别为 ,①和⑥中都用到的仪器为 ;
(2)试剂x的化学式为H2O2;x与溶液B反应的离子方程式为 ;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN﹣ 被过量的氧化剂氧化所致,现给出以下试剂:1.0mol•L﹣1硫酸、1.0mol•L﹣1 NaOH溶液、0.1mol•L﹣1 Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水.请你设计合理实验验证乙同学的猜测是否合理.简要说明实验步骤和现象 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com