
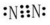 .
.分析 (1)硅原子最外层含有4个电子,两个2s电子、两个2p电子,2s能级含有一个轨道,2p能级有3个轨道,同一能级上电子能量相同;
(2)上述反应中涉及到的两种非金属元素单质的单质为Cl2和Si,比较单质的熔点,可从单质构成的晶体种类来判断;
(3)反应中涉及到的六种元素中,Na+、Al3+、O2-具有氖原子电子层结构,核电荷数越大其简单离子的半径越小;参与上述反应且位于一周期的Na、Al、Si、Cl四种元素中,其最高价氧化物的水化物为酸或碱,酸或碱反应生成盐和水;
(4)根据v=$\frac{△c}{△t}$计算;达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不变,以此判断是否达到平衡状态;
(5)在一定温度下,可逆反应达到平衡时,产物浓度计量系数次方的乘积与反应物浓度计量系数次方的乘积之比为平衡常数;非极性分子的正负电荷重心重合,只有非极性键构成的分子是非极性分子;
(6)温度升高,反应速率加快,化学平衡常数只与温度有关,改变温度平衡正向移动时平衡常数增大.
解答 解:(1)硅原子最外层含有4个电子,两个2s电子、两个2p电子,2s能级含有一个轨道,2p能级有3个轨道,2个电子占据2s能级,两个电子占据2p能级上两个轨道,所以硅原子的最外层电子占据了3个轨道,同一能级上电子能量相同,有2种能量,故答案为:3;2;
(2)Cl2是分子晶体,Si是原子晶体,原子晶体的熔点明显高于分子晶体,则单质熔点高低顺序是Si>Cl2,
故答案是:Si;Cl2;原子晶体Si的熔点明显高于分子晶体Cl2的熔点;
(3)O、Na、Al的核电荷数递增,Na+、Al3+、O2-具有氖原子电子层结构,结合核电荷数越大其简单离子的半径越小,离子半径从小到大的顺序排列为Al3+、Na+、O2-,参与上述反应且位于同一周期的几种元素中,其最高价氧化物的水化物为酸或碱,酸或碱反应生成盐和水,只有氢氧化钠能和其它三种元素的最高价氧化物的水化物反应,则该元素为Na,故答案为:Al3+<Na+<O2-;钠;
(4)υ(NO)=$\frac{1}{2}$v(N2)=$\frac{\frac{0.4mol}{2L}}{20min}$×$\frac{1}{2}$=0.005mol/(L•min);
a.因容器的体积不变,气体的质量不变,气体密度不变不能作为判断是否平衡的依据,但平衡时密度一定不变,故a不选;
b.气体颜色不变,说明浓度不变,可说明达到平衡状态,故b选;
c.υ(NO)正=2υ(N2)逆,正逆反应速率不等,不能达到平衡状态,故c不选;
d.气体的总质量始终不变,反应前后气体总物质的量改变,平均式量不变,说明达到平衡状态,故d选;
故答案为:0.005;bd;
(5)反应2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)平衡常数的表达式K=$\frac{{c}^{2}({N}_{2})×{c}^{3}({H}_{2}O)}{{c}^{2}(N{H}_{3})×c(NO)×c(N{O}_{2})}$,N2是只有非极性键构成的非极性分子,其电子式为: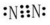 ;
;
答案为:$\frac{{c}^{2}({N}_{2})×{c}^{3}({H}_{2}O)}{{c}^{2}(N{H}_{3})×c(NO)×c(N{O}_{2})}$;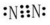 ;
;
(6)温度升高,反应速率加快,速率υ(N2)逆增大,但不知道此反应正方向是吸热还是放热,无法判断升高温度时平衡移动的方向,
平衡常数无法确定是增大还是减小;
答案为:增大;无法确定.
点评 本题以硅为载体考查了化学速率的计算、平衡状态的判断、物质之间的反应、元素周期律等知识点,综合性较强,根据物质的性质、元素周期律的内容等知识点来分析解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 200 mL 2mol/LNaCl溶液 | B. | 75mL 1 mol/L MgCl2溶液 | ||
| C. | 150 mL 3mol/LKCl溶液 | D. | 25 mL 2 mol/L AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ |
| ④ | ⑤ | ⑥ |
| A. | ①~⑥不可能出现金属元素 | |
| B. | 气态氢化物的稳定性:②>③ | |
| C. | 原子半径:①>②>③>④ | |
| D. | ④的最高价氧化物对应的水化物可能为两性物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 国际单位制中的一个物理量 | B. | 摩尔是表示物质的量 | ||
| C. | 摩尔是物质的量的单位 | D. | 摩尔是表示物质数量的单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验溶液中是否含有 CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水 | |
| B. | 检验溶液中是否含有 NH4+:先滴加浓 NaOH 溶液并加热,再用湿润的红色石 蕊试纸 | |
| C. | 检验溶液中是否含有 Fe2+:先滴加氯水,再滴加 KSCN 溶液 | |
| D. | 检验溶液中是否含有 SO42-:先滴加氯化钡溶液,再滴加稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中的所有原子处于同一平面中 | |
| B. | 氯乙烯中所有原子不可能处于同一平面中 | |
| C. | 3-甲基戊烷的一氯代产物有4种(不考虑立体异构) | |
| D. | 分子式为C3H6Cl2的同分异构体共有4种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
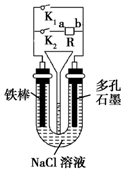
| A. | 若只闭合K1,则铁棒发生的是吸氧腐蚀 | |
| B. | 若要保护铁棒不被腐蚀,则只闭合K2且a极为负极 | |
| C. | 若只闭合K2,一段时间后,U形管中出现白色沉淀,则a极为正极 | |
| D. | 先只闭合K2,两极均产生气体,漏斗液面上升,然后再只闭合K1,漏斗液面不会下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶于足量稀HNO3中:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 将过量的SO2+ClO-+H2O═HClO+HSO3- | |
| D. | 将0.2mol•L-1NH4HCO3溶液与0.3 mol•L-1Ba(OH)2溶液等体积混合:HCO3-+NH4++Ba2++2OH-═NH3•H2O+H2O+BaCO3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com