
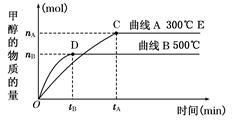
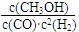 ��Kֵ��С ��2��v��H2����
��Kֵ��С ��2��v��H2����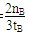 mol/��L��min�� ��3��bc��
mol/��L��min�� ��3��bc��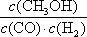 ����ͼ���֪�ﵽƽ��������¶ȣ��״������ʵ�����С��ƽ�������ƶ�������ӦΪ���ȷ�Ӧ����Ϊ�����¶�ƽ�������ȷ����ƶ������������¶�ƽ�����ƣ�K��С��
����ͼ���֪�ﵽƽ��������¶ȣ��״������ʵ�����С��ƽ�������ƶ�������ӦΪ���ȷ�Ӧ����Ϊ�����¶�ƽ�������ȷ����ƶ������������¶�ƽ�����ƣ�K��С��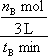 ��2=
��2=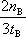 mol?(L?min)��1��
mol?(L?min)��1�� CH3OH(g)����ѹǿ��ѹ������������淴Ӧ���ʶ�����ƽ�������ƶ����״������ʵ����������������ʵ�����С�����������С��������Ũ������b��c��ȷ����ѡbc��
CH3OH(g)����ѹǿ��ѹ������������淴Ӧ���ʶ�����ƽ�������ƶ����״������ʵ����������������ʵ�����С�����������С��������Ũ������b��c��ȷ����ѡbc��

 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 xC(g)+2D(g)��2minĩ��Ӧ�ﵽƽ��״̬, ������0.8molD�������C��Ũ��Ϊ0.4mol��L������д���пհף�
xC(g)+2D(g)��2minĩ��Ӧ�ﵽƽ��״̬, ������0.8molD�������C��Ũ��Ϊ0.4mol��L������д���пհף�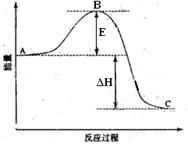 (6)���������Ӧ����ͬ�����´��淴Ӧ��ʼ���У���ʼ����C��D��4/3mol��Ҫʹƽ��ʱ�����ʵ�����������ԭƽ��ʱ��ȫ��ȣ���Ӧ���� ���� mol��
(6)���������Ӧ����ͬ�����´��淴Ӧ��ʼ���У���ʼ����C��D��4/3mol��Ҫʹƽ��ʱ�����ʵ�����������ԭƽ��ʱ��ȫ��ȣ���Ӧ���� ���� mol���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������0.8 mol | B������1.6 mol |
| C������0.8 mol��1.6 mol? | D������1.6 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ֻ�Т� | B���Ţ� | C���ƢǢ� | D���Ţ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z��g������X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3������Ϊ�㣩���ﵽƽ��ʱ��X��Y��Z��Ũ�ȷֱ�Ϊ0��1 mol/L��0��3 mol/L��0��08 mol/L���������ж���ȷ���ǣ�������
2Z��g������X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3������Ϊ�㣩���ﵽƽ��ʱ��X��Y��Z��Ũ�ȷֱ�Ϊ0��1 mol/L��0��3 mol/L��0��08 mol/L���������ж���ȷ���ǣ�������| A��c1��c2��3��1 |
| B��ƽ��ʱ��Y��Z����������֮��Ϊ2��3 |
| C��c1��ȡֵ��ΧΪ0��04 mol/L��c1��0��14 mol/L |
| D��X��Y��ת������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3��g������H<0����ijһʱ����з�Ӧ�����뷴Ӧ���̵���������ͼ��ʾ����NH3�İٷֺ�����͵�һ��ʱ����
2NH3��g������H<0����ijһʱ����з�Ӧ�����뷴Ӧ���̵���������ͼ��ʾ����NH3�İٷֺ�����͵�һ��ʱ����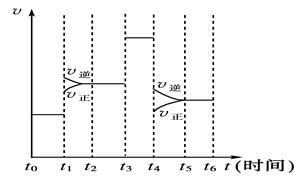
| A��t0��t1 | B��t2��t3 | C��t3��t4 | D��t5��t6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 cC(g) + dD(g)����H="Q" kJ/mol����Ӧ�����У���������������ʱ��ij�����ڻ�����еĺ������¶�(T)��ѹǿ(P)�Ĺ�ϵ��ͼ��ʾ����ͼ������������ȷ����
cC(g) + dD(g)����H="Q" kJ/mol����Ӧ�����У���������������ʱ��ij�����ڻ�����еĺ������¶�(T)��ѹǿ(P)�Ĺ�ϵ��ͼ��ʾ����ͼ������������ȷ����
| A��T1��T2��Q��0 | B��Tl��T2��Q��0 |
| C��P1��P2��a+b=c+d | D��Pl��P2��b=c+d |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��X2 + 2Y2 2XY2 2XY2 | B��2X2 + Y2 2X2Y 2X2Y |
C��3X2 + Y2 2X3Y 2X3Y | D��X2 + 3Y2 2XY3 2XY3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com