
. |
. |

| ������ |
| ��� |
| 300�� |
| ���ʹ��� |
| 300�� |
| ���ʹ��� |
| c(CH4)?c2(H2O) |
| c(CO2)��c4(H2) |
| ||
| tA |
| 4nA |
| VtA |
| c(CH4)?c2(H2O) |
| c(CO2)��c4(H2) |
| 4nA |
| VtA |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������þ��ϡ���ᷴӦ��H++OH-�TH2O |
| B���Ȼ�����Һ����������Һ��Ӧ��Ba2++SO42-�TBaSO4�� |
| C��̼������Һ���������ᷴӦ��Na2CO3+2H+�T2Na++CO2��+H2O |
| D��FeCl3��Һ�м���Fe�ۣ�Fe3++Fe�T2Fe2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� ��ȥCO�����е�CO2���� |
B�� ������ƿ��ת��Һ�� |
C�� ������ƽ���������ƹ������� |
D�� ���뻥�����ܵ�����Һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� ��ϴ��װ�ã���ȥ�����е��Ȼ��� |
B�� ��ȡ���� |
C�� �������Ʊ��������������۲�����ɫ |
D��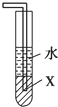 ��X��Ϊ���Ȼ�̼�����������հ���������ֹ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���Ҵ� | B��һ������ |
| C���������� | D�����Ȼ�̼ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | Cu��OH��2 | Fe��OH��2 | Fe��OH��3 |
| Ksp | 2.2��10-20 | 8.0��10-16 | 1.25��10-36 |


| c(Cu2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |
| c(CuCO2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com