
| A. | 第n周期的最后一种金属元素处在第n主族(n>1) | |
| B. | m=1与m=7的元素单质相互化合时,都能形成离子化合物 | |
| C. | 第n周期有8-n种非金属元素(n>1,包括稀有气体元素) | |
| D. | m-n=5的主族元素存在本周期最强的对应含氧酸 |
分析 A.金属元素的最外层电子数≤周期数,第n周期的最后一种金属元素最外层电子数为n,为主族元素,族序数等于最外层电子数;
B.H和Cl形成的化合物为HCl,是共价化合物;
C.第2周期有2种主族金属元素为Li、Be,第3周期有3种主族金属元素为Na、Mg、Al,类推判断;
D.最强的含氧酸为HClO4,其中Cl元素最外层电子数-电子层数=4.
解答 解:A.金属元素的最外层电子数≤周期数,第n周期的最后一种金属元素最外层电子数为n,为主族元素,族序数等于最外层电子数,该处于第n主族,故A正确;
B.H和Cl形成的化合物为HCl,是共价化合物,故B错误;
C.第2周期有2种主族金属元素为Li、Be,第3周期有3种主族金属元素为Na、Mg、Al,类推知第n周期有n种主族金属元素,故C正确;
D.m-n=5的主族元素对应含氧酸的酸性不一定最强,如第三周期中酸性最强的含氧酸为HClO4,而Cl元素最外层电子数-电子层数=4,故D错误;
故选AC.
点评 本题考查元素周期表的结构和应用,题目难度不大,注意把握元素周期表的结构特点,学习中善于把握相关组成规律,在解答题目时会起到事半功倍的作用.


科目:高中化学 来源: 题型:实验题
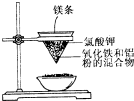 用如图所示的装置进行实验,回答下列问题:
用如图所示的装置进行实验,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 侯氏制碱法的主要原料是NaCl、CO2和NH3 | |
| B. | Na2CO3的热稳定性低于NaHCO3 | |
| C. | 该方法的副产物是NH4Cl | |
| D. | 母液可循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ⑥ | ⑦ | ⑧ | |||||
| 3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
| 4 | ② | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 族 周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 |
| 2 | ④ | ⑦ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑥ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用纯碱制烧碱 2KOH+Na2CO3=K2CO3+2NaOH 复分解反应 | |
| B. | 我国古代的“湿法炼铜”:2Fe+3CuSO4=3Cu+Fe2(SO4)3置换反应 | |
| C. | 用天然气作燃料 CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O 氧化反应 | |
| D. | 证明金属镁的活动性比铁强:3Mg+2Fe(OH)3=3Mg(OH)2+2Fe 置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定不含I- | B. | 肯定含SO42- | C. | 肯定含有SO32- | D. | 肯定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 40 g NaOH溶解在1 L水中,所制得的溶液,物质的量浓度为1 mol•L-1 | |
| C. | 标准状况下,11.2 L四氯化碳所含分子数为0.5NA | |
| D. | 常温常压下,5.6g铁与过量的盐酸反应转移电子总数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com