
| A. | CH4、C2H4、C3H4 | B. | C2H6、C3H6、C4H6 | C. | CH4、C2H6、C3H8 | D. | C2H4、C2H6、C3H4 |
分析 常温常压下水为液态,设烃的混合物的平均化学式为CxHy,在氧气中燃烧的化学方程式为CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(l),结合体积变化及差量法计算.
解答 解:设烃的混合物的平均化学式为CxHy,在氧气中燃烧的化学方程式为CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(l),则
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(l)△V
1 1+$\frac{y}{4}$
50 100
$\frac{1}{1+\frac{y}{4}}$=$\frac{50}{100}$,
解得y=4,
即混合气体分子中平均含有4个H原子,只有A符合,
故选A.
点评 本题考查化学反应方程式的有关计算,为高频考点,把握有机物燃烧规律、烃完全反应、体积差为解答的关键,侧重分析与计算能力的考查,注意差量法及平均值法的应用,题目难度不大.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 95g | B. | 10g | C. | 50g | D. | 100g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
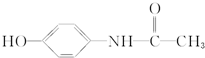 百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧.其主要化学成分的结构简式如下,下列有关该有机物的叙述正确的是( )
百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧.其主要化学成分的结构简式如下,下列有关该有机物的叙述正确的是( )| A. | 分子式为C8H10NO2 | |
| B. | 该有机物属于α-氨基酸 | |
| C. | 该有机物属于α-氨基酸的同分异构体有3种 | |
| D. | 该有机物与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

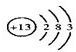 ; F的化学式FeCl2.
; F的化学式FeCl2.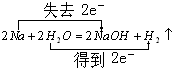 .反应②:
.反应②: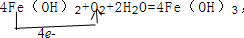 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.5 mol•L-1CuCl2溶液中含有Cu2+的个数为0.5NA | |
| B. | 18 g重水(D2O)所含的电子数为10NA | |
| C. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.1NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成56g N2时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛是一种氧化物 | |
| B. | 甲醛中C、H、O的质量比为6:1:8 | |
| C. | 甲醛分子中含有氢分子 | |
| D. | 甲醛是由一个碳原子和一个水分子构成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com