
已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液 (填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”)。
(2)某温度下,若向0.1 mol/L的NaHA溶液中滴入0.1 mol/L KOH溶液使混合溶液中c(H+)=c(OH-),则此时该混合溶液中,下列关系一定正确的是 (填字母)。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq) ΔH>0
Ca2+(aq)+A2-(aq) ΔH>0
①温度升高时,Ksp (填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+) 。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式: 。
(1)酸碱性无法确定 (2)B、C (3)①增大 ②增大
(4)CaA(s)+Cu2+(aq) Ca2+(aq)+CuA(s)
Ca2+(aq)+CuA(s)
【解析】(1)HA-是弱酸的酸式酸根离子,既水解又电离,所以酸碱性无法确定。
(2)温度不确定,所以KW不确定,c(H+)·c(OH-)不一定等于1×10-14,A错;B项遵循电荷守恒,正确;因为加入KOH溶液使混合溶液中c(H+)=c(OH-),可知NaHA溶液显弱酸性,所以当溶液显中性时,滴入的KOH溶液的量小于NaHA溶液的量,故c(Na+)>c(K+),C项正确;混合溶液中c(Na+)+c(K+)>0.05 mol/L,D项错误。
(3)Ksp=c(Ca2+)×c(A2-),该过程是吸热过程,升温平衡向右移动,所以Ksp增大;滴加少量浓盐酸,A2-与H+结合,使平衡向右移动,所以c(Ca2+)增大。
(4)沉淀转化为更难溶的沉淀:CaA(s)+Cu2+(aq) Ca2+(aq)+CuA(s)。
Ca2+(aq)+CuA(s)。


科目:高中化学 来源:2014高考化学二轮专题突破 专题九化学反应速率化学平衡练习卷(解析版) 题型:选择题
一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:
2SO2(g)+O2(g)  2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | t1 | t2 | t3 | t4 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前t1s的平均速率v(O2)=0.4/t1 mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)增大
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题一物质的组成性质和分类练习卷(解析版) 题型:选择题
某合作学习小组讨论辨析以下说法,其中正确的是( )
①粗盐和酸雨都是混合物
②沼气和水煤气都是可再生能源
③冰和干冰既是纯净物又是化合物
④不锈钢和目前流通的硬币都是合金
⑤纯碱和熟石灰都是碱
⑥豆浆和雾都是胶体
A.①②③④ B.①②⑤⑥
C.③⑤⑥ D.①③④⑥
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题8电化学原理练习卷(解析版) 题型:填空题
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4 (g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH=-129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置实现上述过程:

①写出阳极电极反应式: 。
②写出除去甲醇的离子方程式: 。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的负极反应式: 。
(4)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图:

①电源的负极为 (填“A”或“B”)。
②阳极室中发生的反应依次为 。
③电解结束后,阴极室溶液的pH与电解前相比将 ;若两极共收集到气体13.44 L(标准状况),则除去的尿素为 g (忽略气体的溶解)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题8电化学原理练习卷(解析版) 题型:选择题
如图所示,将铁棒和石墨棒插入1 L 1 mol·L-1食盐水中。下列说法正确的是( )
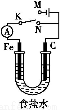
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是:4OH--4e-=2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题7电解质溶液练习卷(解析版) 题型:选择题
现有0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )
①电离程度增大;②c(NH3·H2O)增大;③N 数目增多;④c(OH-)增大;⑤导电性增强;⑥
数目增多;④c(OH-)增大;⑤导电性增强;⑥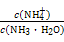 增大
增大
A.①②③ B.①③⑤ C.①③⑥ D.②④⑥
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题6化学反应速率和化学平衡练习卷(解析版) 题型:填空题
T ℃、2 L密闭容器中某一反应在不同时刻的各物质的量如图所示(E为固体,其余为气体)。回答下列问题。
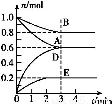
(1)写出该反应的化学方程式: 。
(2)反应开始至3 min时,用D表示的平均反应速率为 mol·L-1·min-1。
(3)T ℃时,该反应的化学平衡常数K= 。
(4)第6 min时,保持温度不变,将容器的体积缩小至原来的一半,重新达到平衡后,D的体积分数为 。
(5)另有一个2 L的密闭容器,T ℃、某一时刻,容器中各物质的物质的量如表所示。
物质 | A | B | D | E |
物质的量(mol) | 0.8 | 1.0 | 0.4 | 0.2 |
此时v(正) v(逆)(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题5物质结构 元素周期律练习卷(解析版) 题型:选择题
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是( )
A.Y元素最高价氧化物对应的水化物化学式为H2YO4
B.原子半径由大到小的顺序为:Z>Y>W
C.X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定
D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1∶2
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题1物质的组成性质分类和化学用语练习卷(解析版) 题型:选择题
下列有关元素化合物的说法正确的是( )
A.CO和SiO2都不能和水反应,所以它们都不是酸性氧化物
B.易溶于水的化合物溶于水的过程一定有化学键断裂的过程
C.Na2O2是离子化合物,但是含有共价键
D.向沸水中逐滴加入1 mL 1 mol/L FeCl3溶液,制得红褐色Fe(OH)3胶体,则胶粒的数目是10-3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com