
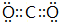 ,B与D形成的原子个数比为1:1的化合物的电子式是
,B与D形成的原子个数比为1:1的化合物的电子式是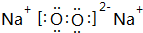 .
.分析 A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族,四种元素在周期表中的大致相对位置为: ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,则A为C元素,C为Si元素,D为Na元素,据此解答该题.
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,则A为C元素,C为Si元素,D为Na元素,据此解答该题.
解答 解:A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族,四种元素在周期表中的大致相对位置为: ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,则A为C元素,C为Si元素,D为Na元素.
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,则A为C元素,C为Si元素,D为Na元素.
(1)由上述分析可知,A为碳、B为氧、C为硅、D为钠,
故答案为:碳;氧;硅;钠;
(2)A与B形成的三原子分子为CO2,其电子式是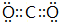 ,B与D形成的原子个数比为1:1的化合物为Na2O2,其电子式是
,B与D形成的原子个数比为1:1的化合物为Na2O2,其电子式是 ,
,
故答案为: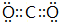 ;
; ;
;
(3)A元素某氧化物与D元素某氧化物反应生成单质,应是二氧化碳与过氧化钠反应生成碳酸钠与氧气,反应化学方程式是2CO2+2Na2O2═2Na2CO3+O2,
故答案为:2CO2+2Na2O2═2Na2CO3+O2.
点评 本题考查位置结构性质的关系应用,题目难度中等,关键是正确推断元素的种类,注意根据原子位置关系及半径大小找出其在周期表中的相对位置,理解掌握同主族原子序数关系.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 元素 | W | X | Y | Z |
| 性质或结构信息 | 单质制成的高压灯,发出的黄光透雾力强、射程远. | 工业上通过分离液态空气获得其单质.原子的最外层未达到稳定结构. | 单质常温常压下是气体,原子的M层差一个电子达稳定结构. | +2价阳离子的核外电子排布与氖原子相同. |
| A. | 上表中与W属于同一周期的元素是Z和Y | |
| B. | Z和Y形成的化合物属于离子化合物 | |
| C. | X的氢化物常温、常压下一定为液体 | |
| D. | Y单质为有色气体,具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基态原子是处于最低能量状态的原子 | |
| B. | 基态C原子的电子排布式是1s22s12p3 | |
| C. | 焰色反应是金属原子的电子从基态跃迁到激发态时产生的光谱 | |
| D. | 同一原子处于激发态时的能量一定低于基态时的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素名称 | 氟 | 氧 | 溴 | 碘 |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
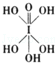 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定存在① | B. | 至少存在②和⑤ | C. | 无法确定是否有③ | D. | 至少存在①、④、⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
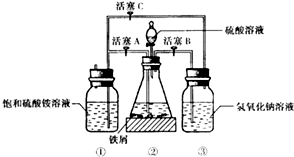
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的最外层电子数:X>Y>Z | B. | 单质沸点:Z>Y | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com