
| A. | 496 | B. | 118 | C. | 350 | D. | 130 |
分析 化学反应中旧键断裂需要吸收能量,新键形成需要放出能量,根据盖斯定律计算水分解反应的焓变,化学反应的焓变△H=反应物总键能-生成物总键能,再结合化学键能和物质能量的关系来回答.
解答 解:已知①C(s)+H2O(g)═CO(g)+H2(g)△H=+130kJ•mol-1,
②2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1
根据盖斯定律得①×2-②得:2H2O(g)═O2(g)+2H2(g)△H=(+130kJ•mol-1)×2+(-220kJ•mol-1)=480kJ•mol-1,
△H=反应物总键能-生成物总键能,则4×462kJ•mol-1-a kJ•mol-1-462kJ•mol-1=480kJ•mol-1,解得:a=496 kJ•mol-1;
故选A.
点评 本题考查学生盖斯定律的应用以及化学反应的能量和化学键键能之间的关系,注意知识的迁移和应用是关键,难度中等.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:解答题
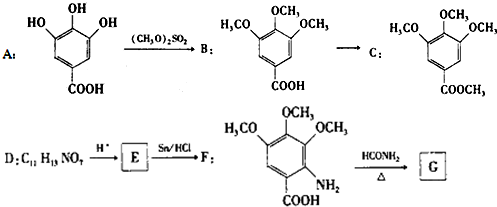
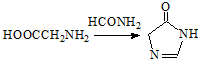
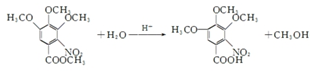 .
.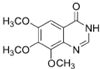 .
.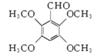 .
.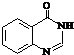 .合成过程中无机试剂任选.
.合成过程中无机试剂任选.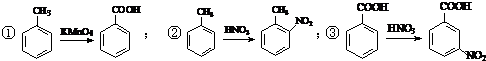 )
)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将amol/L的Na2RO3溶液与bmol/L的NaHRO3溶液等体积混合后,若c(Na+)>c(HRO3-)>c(RO32-)>c(OH-)>c(H+),则a<b | |
| B. | 0.1mol•L-1NH4HS溶液中:c(NH4+)=c(HS-)+c(S2-)+c(H2S) | |
| C. | 若KHA溶液呈弱酸性,则c(K+)>c(A2-)>c(HA-)>c(H+)>c(OH-) | |
| D. | 向AgNO3溶液中逐滴滴加等物质的量浓度的KCl和K2CrO4的混合溶液,若先产生白色沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
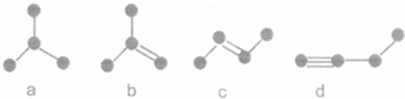
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
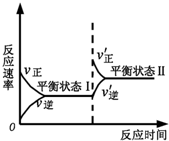
| A. | 反应达平衡时,正反应速率和逆反应速率相等 | |
| B. | 该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ | |
| C. | 该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ | |
| D. | 同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和NaHCO3均可与澄清石灰水反应 | |
| B. | NaHCO3比Na2CO3热稳定性强 | |
| C. | 相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同 | |
| D. | Na2CO3俗名小苏打,NaHCO3俗名纯碱,其溶液均显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,2LpH=12的氨水中含有OH-数目为0.02NA | |
| B. | 氯碱工业中,外电路中转移电子数为0.3NA时产生气体体积(标准状况)为4.48L | |
| C. | 标准状况下,11.2LCH3Cl中非极性共价键数目等于2.0NA | |
| D. | 一定条件下,1molI2和0.2molH2混合充分反应,转移的电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装置 | 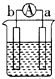 CuSO4溶液 | 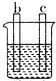 稀硫酸 |  稀硫酸 |
| 现象 | a极质量减小 b极质量增大 | b极有气泡 c极无明显现象 | 电流从a极流向d极 |
| A. | d>a>b>c | B. | b>c>d>a | C. | a>b>c>d | D. | a>b>d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com