
����Ŀ��ij��ɫ��ҵ��ˮ�п��ܺ���Na+��Mg2+��Al3+��Cu2+��Cl����SO42���еļ������ӣ�
a��ȡ0.1mL�÷�ˮ�ڹ��У�����������Ba��N03����Һ��ϡ���ᣬ������ɫ��������ַ�Ӧ����ˣ�����Һ�м���AgNO3��Һ����������
b����ȡ10mL�÷�ˮ�ڹ��У��μ�NaOH��Һ�Ȳ�����ɫ�������ֳ����ܽ⣮���ɳ��������ʵ��������NaOH���ʵ�����ϵ��ͼ��ʾ��
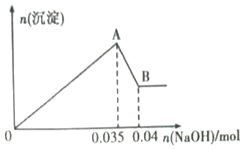
��������ʵ���ͼ�����ݣ�
��1���÷�ˮ��һ�������е�������______________�������ӷ��ţ���
��2��ʵ��������100mL1molL��1��NaOH��Һʱ���õ��IJ����������ձ�������������Ͳ�⣬����Ҫ_____________�����������ƣ���
��3��д��A��B�����з�����Ӧ�����ӷ���ʽ��_________________________��
��4���÷�ˮ�У�c��Al3+��=_______________________��
���𰸡� Cu2+��Cl�� 100mL����ƿ����ͷ�ι� Al��OH��3+OH��=AlO2��+H2O 0.5mol/L
����������ɫ��Һ�в��������ɫ��Cu2+��
a��ȡ0.1mL�÷�ˮ�ڹ��У�����������Ba��NO3����Һ��ϡ���ᣬ������ɫ�������ó���Ϊ���ᱵ����ԭ��Һ�к���SO42������ַ�Ӧ����ˣ�����Һ�м���AgNO3��Һ����������˵��ԭ��Һ�в�����Cl����
b����ȡ10mL�÷�ˮ�ڹ��У��μ�NaOH��Һ�Ȳ�����ɫ�������ֳ����ܽ⣬�ܽ�ij���Ϊ�������������ܵij���Ϊ������þ����ԭ��Һ��һ������Mg2+��Al3+��
��1�����ݷ�����֪���÷�ˮ��һ�������е������У�Cu2+��Cl����
��2��ʵ��������һ��Ũ�ȵ�NaOH��Һʱ���õ��IJ����������ձ�������������Ͳ�⣬����100mL��Һ����ѡ�ù��Ϊ100mL������ƿ������ʱ����ʹ�ý�ͷ�ιܣ�
��3��A��B����Ϊ�����ܽ�Ĺ��̣������������������Ʒ�Ӧ����ƫ�����ƺ�ˮ����Ӧ�����ӷ���ʽΪ��Al��OH��3+OH��=AlO2��+H2O��
��4�����ݷ�ӦAl��OH��3+OH��=AlO2��+H2O��֪��n[Al(OH)3]=n(NaOH)=0.04mol-0.035mol=0.005mol�����������غ��֪ԭ��Һ�������ӵ����ʵ���Ϊ0.005mol����ԭ��Һ�������ӵ�Ũ��Ϊ��c(Al3+)=![]() =0.5mol/L��
=0.5mol/L��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һͬѧ��ij�ִ��ν����ᴿʵ�飬�������ͼ��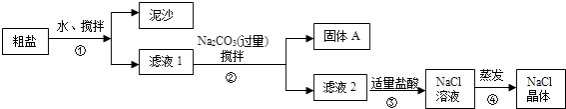
��ش�
��1������ٺ͢ڵIJ��������� ��
��2��������жϼ������ᡰ�������ķ�����������ܼ�������ʱҪ�ò��������Ͻ��裬����Ϊ�˷�ֹ �� �����������н϶����������ʱ��Ӧ �� ������ʹˮ�����ɣ�
��3���������֤��
���� | ��֤�ķ��� | ���� | ���� |
�������A�к� | ȡ��������A���Թ��У��μ�ϡ���ᣬ����Ϳ�г���ʯ��ˮ��С�ձ������Թܿ� |
| �������� |
�������A�к� | ȡ��������A���Թ��У��ȵ��� �� �ٵ���Na2SO4��Һ | �����ݷų����ް�ɫ���� | |
���������Ƶõ�NaCl�����л�����Na2SO4 | ȡ����NaCl���������Թ��е�����ˮ�� |
| �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��aA��g��+bB��g��cC��g��+dD��g��������ͼ1��2�ش� 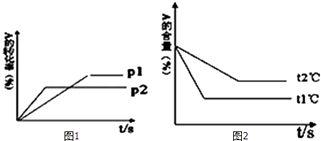
��1��ѹǿ P1��P2�����С������
��2����a+b���ȣ�c+d�������С������
��3���¶�t1���t2������ߡ��͡�����
��4������ӦΪ��Ӧ������ȡ����ȡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ũ�Ⱦ�Ϊ0.1 mol/L���������ʵ���Һ�У�c(Cl��)������( )
A. FeCl3B. CuCl2C. KClD. NaClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж��ֺ����ᣬ�����ᣨH2SO3�������ᣨH2SO4���������ᣨH2SO4SO3����������ᣨH2S2O3���ȵȣ�����������Ϊ��Ҫ���ڹ�ҵ���й㷺��Ӧ�ã���ʵ���ң�Ũ�����dz��õĸ������������м��㣺
��1�������ᣨH2SO4 �� SO3������ˮ�����е�SO3��ת��Ϊ���ᣮ����445g����������ˮ���4.00L���ᣬ����������ʵ���Ũ��Ϊmol/L��
��2������Ũ������ˮ������H2SO4 �� H2O���㣬250g��������Ϊ98%�����������ն���gˮ��
��3���������ǹ�ҵ�����������Ҫԭ�ϣ��������������յĻ�ѧ��Ӧ���£�3FeS2+8O2��Fe3O4+6SO2 4FeS2+11O2��2Fe2O3+8SO2
��48molFeS2��ȫ��Ӧ��������2934.4L����״���������㷴Ӧ������Fe3O4��Fe2O3���ʵ���֮�ȣ�
��4����������ȡ���ᣬ���ܳ��������Դ���ܱ�����������һ�ֺ��з�չǰ;���Ʊ�����ķ����������������Ϊ0.84�Ļ�����壨H2S��H2O��N2���ڿ�������ȫȼ�գ�����������77%���������������SO2���������ˮ�����壩��
��֪������ɣ�N2�������0.79��O2�������0.21��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���ͼװ�õ�˵����ȷ���ǣ� �� 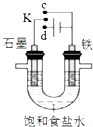
A.��K��c���ӣ�ʯī�缫�ĵ缫��ӦΪ��O2+4e��+4H+=2H2O
B.��K��c���ӣ�����Һ�е�Na+�����缫�ƶ�
C.��K��d���ӣ����缫�ĵ缫��ӦΪ��2H++2e���TH2��
D.��K��d���ӣ�һ��ʱ�������ϡ�����ʹ�������Һ��ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ƿ��ʵ�飬��������̵���(����)
ˮ | ������ | 0.1%�Ǽ��� | NaOH��Һ | �¶� | |
A | 50 mL | 1.5 g | 8�� | 2 mL | 40 �� |
B | 50 mL | 1.5 g | 10�� | 2 mL | 40 �� |
C | 50 mL | 1.5 g | 8�� | 2 mL | 25 �� |
D | 50 mL | 1.5 g | 10�� | 2 mL | 25 �� |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ժȡѧ��ʵ�鱨�浥�е���䣬����˵����ȷ����( )
A.�ճ������в�������������������Ƿ���KIO3
B.����м��Ũ��ˮ������Ͽ��Ƶ��屽
C.��������ȥ�Ҵ��е�ˮ
D.ϴ�ӳ���ʱ��Ӧ�ò�����������裬ʹ�ó��������ϵ���������ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ڱ�״���£�������NO2���Թܵ��۵�ʢˮ��ˮ���У�һ��ʱ����Թ��������������Թ������________________�������Թ������ʲ���ɢ�����Թ�����Һ�����ʵ����ʵ���Ũ��Ϊ___________________��
��2��ij����������������Ʒ����5mol/L������100mLǡ����ȫ�ܽ⣬������Һ�������ձ�״����1.12L������ʹ����Fe2+ǡ��ȫ��ת��ΪFe3+��������Ӧ�����ӷ���ʽΪ_________������Ʒ��Fe��O�ĸ�����Ϊ_______________��
��3����ʢ��10mL1mol/LNH4Al(SO4)2��Һ���ձ��еμ�1mol/LNaOH��Һ���������ʵ�����NaOH��Һ����仯ʾ��ͼ������(��֪NH4++OH-=NH3��H2O)
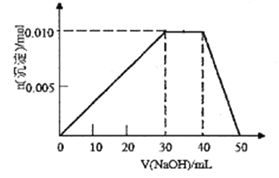
��д���μ�NaOH��Һ40��50mLʱ��Ӧ�����ӷ���ʽ��__________________��
����10mL1mol/LNH4Al(SO4)2��Һ�иļ�20mL1.15mol/LBa(OH)2��Һ����ַ�Ӧ����Һ�в������������ʵ���Ϊ_________________mol��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com