
【题目】化合物X为医用药物,它的合成路线如下:

已知:①1. RCH=CH2
②RBr ![]() RMgBr
RMgBr ![]()
③ RCHO+R’CH2CHO+![]()
(1)A的名称为______,A分子中最多______个原子共面。
(2)写出第①步反应条件______;F的结构简式______;第⑤步反应类型:______;
(3)第③步的化学反应方程式:______;G和![]() 合成聚酯纤维宇航服的化学反应方程式:______;
合成聚酯纤维宇航服的化学反应方程式:______;
(4)G经反应可得到![]() ,写出K的同分异构体中含有一个手性碳(连有四个不同取代基的碳称为手性碳原子)的结构简式______。
,写出K的同分异构体中含有一个手性碳(连有四个不同取代基的碳称为手性碳原子)的结构简式______。
(5)已知:![]() 写出由1-戊醇和必要无机试剂合成G的路线,并在括号注明条件
写出由1-戊醇和必要无机试剂合成G的路线,并在括号注明条件
1-戊醇![]() _____
_____![]() ______________(______)G。
______________(______)G。
【答案】1-戊烯 9 HBr,适当溶剂 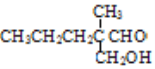 加成反应
加成反应 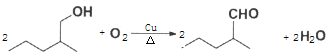
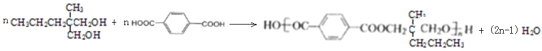
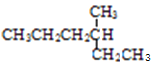 、
、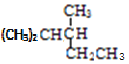
![]()
![]() H2,催化剂、加热
H2,催化剂、加热
【解析】
A为烃,相对分子质量为70,用商余法:![]() =5
=5![]() 10,则A的分子式为C5H10。根据各物质的转化关系及分子式可以知道,A为CH3CH2CH2CH=CH2,A与溴化氢发生加成反应生成B为CH3CH2CH2CHBrCH3,B发生信息②中的反应生成C为CH3CH2CH2CH(CH3)MgBr,C反应生成D;E→F为信息③中的反应,根据D的结构可以知道,E为CH3CH2CH2CH(CH3)CHO,则F为
10,则A的分子式为C5H10。根据各物质的转化关系及分子式可以知道,A为CH3CH2CH2CH=CH2,A与溴化氢发生加成反应生成B为CH3CH2CH2CHBrCH3,B发生信息②中的反应生成C为CH3CH2CH2CH(CH3)MgBr,C反应生成D;E→F为信息③中的反应,根据D的结构可以知道,E为CH3CH2CH2CH(CH3)CHO,则F为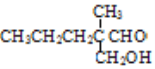 ,F发生还原反应生成G为
,F发生还原反应生成G为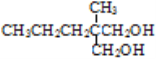 ,G与
,G与![]() 发生加成反应生成X,据此答题。
发生加成反应生成X,据此答题。
(1)根据以上分析,A为CH3CH2CH2CH=CH2,名称为1-戊烯;CH3CH2CH2CH=CH2可看做乙烯中的一个氢原子被正丙基取代,根据乙烯分子6原子共平面,而单键可旋转,烷基四面体中可能有一个原子在这个平面上,所以A分子中最多可以有6+1+2=9个原子共面,
因此,本题正确答案是:1-戊烯;9;
(2) 根据转化关系,第①步反应为由A(CH3CH2CH2CH=CH2)生成B(CH3CH2CH2CHBrCH3),故条件为HBr,适当溶剂;F的结构简式为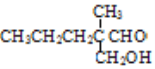 ;第⑤步反应类型为加成反应,
;第⑤步反应类型为加成反应,
因此,本题正确答案是:HBr,适当溶剂;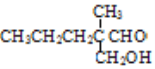 ;加成反应;
;加成反应;
(3)第③步反应为醇的催化氧化反应,化学反应方程式为: ;
;
G为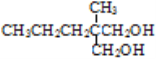 ,G和
,G和![]() 发生缩聚反应合成聚酯纤维宇航服的化学反应方程式为:
发生缩聚反应合成聚酯纤维宇航服的化学反应方程式为: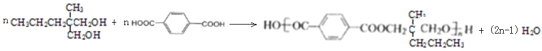 ,
,
因此,本题正确答案是: ;
;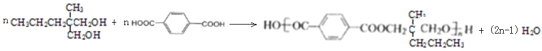 ;
;
(4) G为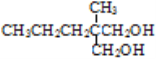 ,G经反应可得到
,G经反应可得到![]() ,K的同分异构体中含有一个手性碳的结构简式为:
,K的同分异构体中含有一个手性碳的结构简式为: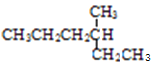 、
、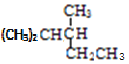 ,
,
因此,本题正确答案是: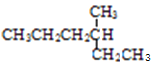 、
、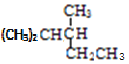 ;
;
(5) G为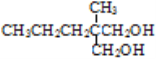 ,由合成路线可知,1-戊醇发生催化氧化生成戊醛(CH3CH2CH2CH2CHO),戊醛发生信息中的反应生成
,由合成路线可知,1-戊醇发生催化氧化生成戊醛(CH3CH2CH2CH2CHO),戊醛发生信息中的反应生成![]() ,再还原可得G,故合成路线为:
,再还原可得G,故合成路线为:![]() ,
,
因此,本题正确答案是:![]() ;
;![]() ;H2,催化剂、加热。
;H2,催化剂、加热。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g) ![]() 2C(g)+2D(g)在四种不同情况下的反应速率分别为
2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1,该反应进行的快慢顺序为
A. ④>③=②>① B. ④<③=②<① C. ①>②>③>④ D. ④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下图是由常见元素组成的一些单质及其化合物之间的转化关系图。A是由单质C在D中燃烧生成的淡黄色固体。B是最常见的无色液体,常温常压下,D、F、K均为无色无刺激性气味的气体。H和I焰色反应均为黄色。(反应中生成的部分物质已略去)

请回答下列问题:
(1)物质A的化学式为________。
(2)反应①的离子方程式为__________。
(3)反应②的化学方程式为_________。
(4)上述转化H→I的反应离子方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 电解熔融金属氯化物制备Na、Mg、Al
B. 配制![]() 溶液时需加入稀硝酸防止水解
溶液时需加入稀硝酸防止水解
C. “一带一路”中的丝绸的主要成分是天然纤维素,属于高分子化合物。
D. 牙齿的矿物质Ca5(PO4)3OH+F-![]() Ca5(PO4)3F+OH-,故使用含氟牙膏可以防止龋齿的形成
Ca5(PO4)3F+OH-,故使用含氟牙膏可以防止龋齿的形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于四个“封管实验”![]() 夹持装置未画出、
夹持装置未画出、![]() 固体易升华
固体易升华![]() 的说法正确的是
的说法正确的是
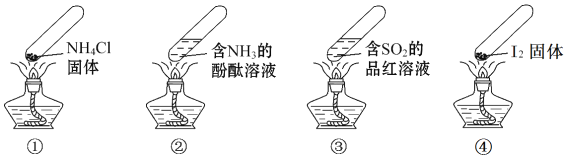
A. 加热时,![]() 中封管内固体消失
中封管内固体消失
B. 加热时,![]() 中溶液变红,冷却后又变为无色
中溶液变红,冷却后又变为无色
C. 加热时,![]() 中溶液变红,冷却后红色褪去,体现
中溶液变红,冷却后红色褪去,体现![]() 的漂白性
的漂白性
D. 加热又冷却的过程中,![]() 属于物理变化,
属于物理变化,![]() 属于化学变化
属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中产生沉淀的物质的量(Y)与加入试剂的物质的量(X)之间的关系正确的是( )
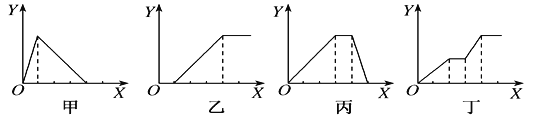
A. 甲向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B. 乙向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
C. 丙向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量
D. 丁向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知海水中的溴含量约为 65 mg·L-1,从海水中提取溴的工业流程如下:

(1)步骤Ⅱ通入热空气吹出 Br2,利用了溴的_______(填序号)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(2)步骤Ⅱ中涉及的离子反应如下,请在横线上填入正确的化学计量数:
___Br2 +___![]() =___
=___![]() + ___Br- +___CO2↑
+ ___Br- +___CO2↑
(3)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后 进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为________________________。
(4)实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有________________(填字母)。
A.乙醇 B.四氯化碳 C.醋酸 D.苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成两者溶液的体积之和),下列说法正确的是( )
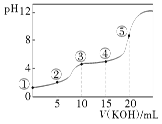
A.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
B.点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1
D.点⑤所示溶液中:c(OH-)= c(H+)+ c(HC2O4-)+ c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,中国华北华中地区发生了严重的雾霾天气。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H<0,在一定温度下,在一体积恒定的密闭容器中充入一定量的NO(g)和CO(g)在t1时刻达到平衡状态。若要同时提高该反应的速率和NO(g)的转化率,可采取的措施_______________。(写一条)
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积恒定的密闭容器中充入一定量的NO(g)和CO(g)在t1时刻达到平衡状态。若要同时提高该反应的速率和NO(g)的转化率,可采取的措施_______________。(写一条)
(2)改变煤的利用方式可减少环境污染,通常可将煤气化转化为水煤气,其反应原理为:C(s)+H2O(g)![]() CO(g)+H2(g) ; △H=+131.3kJ/mol。
CO(g)+H2(g) ; △H=+131.3kJ/mol。
①该反应在_________下能自发进行(填“高温”或“低温”)。
②水煤气燃烧过程中产生的CO2气体可以与“84消毒液”的主要成分NaClO发生反应,该反应的离子方程式为:___________________________________________________。(已知:HClO:Ka=3.0×10ˉ8;H2CO3:Ka1=4.30×10ˉ7;Ka2=5.61×10ˉ11)
(3)已知反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | |
CO | H2O | H2 | |||
1 | 650 | 4 | 2 | 1.6 | 6 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 900 | a | b | c | t |
①实验1条件下平衡常数K=________________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是______。
③该反应的△H ____0(填“<”或“>”);若900℃时,另做一组实验,在此容器中加入10molCO,5mo1H2O,2mo1CO2,5molH2,此时v(正) ___v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com