
现有下列物质:
①Na2CO3 ②铜 ③氯化氢 ④CO2 ⑤NaHSO4 ⑥Ba(OH)2 ⑦氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩KI
(1)按物质的分类方法填写表格的空白处(填物质编号)
分类标准 电解 质 盐 非电解质 混合物
质 盐 非电解质 混合物
属于该类
的物质
(2)上述某两种物质在溶液中可发生离子反应:H++OH﹣═H2O,写出其中一个该离子反应对应的化学方程式 .
(3)物质⑩的稀溶液在空气中被氧化,加入淀粉溶液显蓝色,则反应的离子方程式为: .
考点: 电解质与非电解质;混合物和纯净物;酸、碱、盐、氧化物的概念及其相互联系;离子方程式的书写.
专题: 物质的分类专题;离子反应专题.
分析: (1)水溶液中或熔融状态下能够导电的化合物称为电解质;在上述两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质.大多数的有机物都是非电解质;单质,混合物既不是电解质也不是非电解质;
盐是指由金属离子和酸根离子构成的化合物,是纯净物;
由同种分子构成的物质是纯净物,由不同种分子构成的物质是混合物;
(2)H++OH﹣═H2O表示的是可溶性的强酸和可溶性的强碱发生酸碱中和反应生成可溶性的盐的离子方程式,据此解答;
(3)碘化钾溶液在空气中被氧化生成碘、氢氧化钾,据此解答.
解答: 解:(1)①③⑤⑥⑩都是在水溶液或者熔融状态下能导电的化合物,属于电解质;
④在水溶液和者熔融状态下都不导电的化合物,是非电解质;
⑦⑧⑨都是由不同种分子构成,属于混合物;
①⑤⑩都是由金属离子和酸根离子构成的化合物,属于盐;
②铜是单质,属于纯净物,不是盐,既不是电解质也不是非电解质;
故答案为:①③⑤⑥⑩;①⑤⑩;④;⑦⑧⑨;
(2)氯化氢与氢氧化钡反应的离子方程式为:H++OH﹣═H2O;化学方程式为:Ba(OH)2+2HCl═BaCl2+2H2O,
故答案为:Ba(OH)2+2HCl═BaCl2+2H2O;
(3)碘化钾溶液在空气中被氧化的离子方程式为:O2+4I﹣+2H2O═2I2+4OH﹣,故答案为:O2+4I﹣+2H2O═2I2+4OH﹣.
点评: 本题主要考查了物质的分类,准确理解电解质、非电解质、盐、化合物的概念是解题的关键.


科目:高中化学 来源: 题型:
某溶液中含有Fe2+、Al3+、Ag+、Cu2+,为分别得到各含一种金属阳离子的沉淀物。可采取①通入H2S气体,②通入CO2气体,③加入盐酸,④加入氢氧化钠溶液四个步骤,每次通入或加入试剂均过量,且每次都把沉淀物滤出,其操作的正确顺序是 ( )。
A.③①④② B.①③④②
C.④②①③ D.④②③①
查看答案和解析>>
科目:高中化学 来源: 题型:
列叙述错误的是()
A. NH3的喷泉实验说明氨气极易溶于水
B. NO 和NH3均可用排空气法收集
C. 盛液溴的瓶内加少量水可防止液溴的挥发
D. NH3遇到挥发性的强酸就能冒白烟
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的数值,下列说法正确的是()
A. 标准状况下,22.4LCCl4含有NA个分子
标准状况下,22.4LCCl4含有NA个分子
B. 0.1molAlCl3完全转化为胶体,生成胶体粒子的数目为0.l NA个
C. 常温常压下46gNO2和N2O4的混合气体含有3NA个原子
D. 0.1molCl2与足量冷的NaOH溶液反应,转移电子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的做法错误的是()
A. 用四氯化碳萃取溴水中的溴后,分液时,有机层应从分液漏斗的上口倒出
B. 检验NH4+时,向试样中加入NaOH溶液,微热,用湿润的红色石蕊试纸检验逸出的气体
C. 通过分液漏斗滴加溶液时,应打开上口的玻璃塞或将玻璃塞上的凹槽对准口颈部的小孔
D. 玻璃仪器洗涤干净的标准是:附着在仪器内壁上的水既不聚集成滴,也不成股流下
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
B. 需要通过化学反应才能从海水中获得食盐和淡水
C. 水晶项链和餐桌上的瓷盘都是硅酸盐制品
D. 粗硅制备单晶硅涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为含有同一种元素的a、b、c、d、e五种物质的转化关系.其中a是单质,b是气态氢化物,c、d是氧化物,e是该元素最高价氧化物对应的水化物,则a可能是()
①C②N2③S④F2.
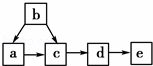
A. 只有①和③ B. 只有④ C. ①②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生将一小块钠投入滴有酚酞的水中,此实验能证明钠下面4点性质中的()
①钠比水轻
②钠的熔点较低
③钠与水反应在时要放出热量
④钠与水反应后溶液呈碱性.
A. ①④ B. ①②④ C. ①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
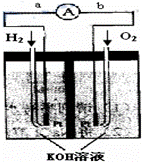
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示).
(2)负极反应式为 .
(3)电极表面镀铂粉的原因为增
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ.2Li+H2 2LiHⅡ.LiH+H2O═LiOH+H2↑
2LiHⅡ.LiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是Li,反应Ⅱ中的氧化剂是H2O.
②用锂吸收224L(标准状况)H2,再由生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 .
③若改用熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极.已知负极的电极反应是CH4+4CO32﹣﹣8e﹣=5CO2+2H2O.则正极的电极反应是 .为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,此电池工作时必须有部分A物质参加循环,则A物质的化学式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com