
| A. | 摩尔是描述微观粒子多少的物理量 | |
| B. | 物质的量将可称量的宏观物质与一定数目微观粒子联系起来 | |
| C. | 1molO2的质量为32g•mol-1 | |
| D. | 22.4L H2的物质的量为1mol |
分析 A.摩尔是物质的量的单位;
B.由m=nM、N=nNA可知,物质的量将可称量的宏观物质与一定数目微观粒子联系起来;
C.1molO2的质量为32g;
D.氢气不一定处于标况下,22.4L氢气物质的量不一定为1mol.
解答 解:A.物质的量是描述微观粒子集合体的物理量,摩尔是物质的量的单位,故A错误;
B.由m=nM、N=nNA可知,物质的量将可称量的宏观物质与一定数目微观粒子联系起来,故B正确;
C.O2的摩尔质量为32g•mol-1,1molO2的质量为32g,故C错误;
D.温度、压强影响气体摩尔体积,氢气不一定处于标况下,22.4L氢气物质的量不一定为1mol,故D错误,
故选:B.
点评 本题考查物质的量、摩尔质量、气体摩尔体积,难度不大,注意气体摩尔体积的使用条件与对象,根据PV=nRT理解温度、压强对气体摩尔体积的影响.


科目:高中化学 来源: 题型:解答题
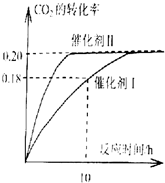 已知CO2可以生产绿色燃料甲醇,反应如下:
已知CO2可以生产绿色燃料甲醇,反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 颜色、性质 | 物质 | 颜色、性质 | |
| 氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 | |
| 氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 | |
| 氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol固体氯化氨中存在离子数小于2NA | |
| B. | 标准状况下,22.4L己烷中共价键的数目为19NA | |
| C. | 标况下的NO2气体22.4L,其中含有的氮原子数为NA | |
| D. | 常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制 Fe(OH)2:Fe2++2OH-═Fe(OH)2↓ | |
| B. | 等物质的量的MgCl2、Ba(OH)2 和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-═Fe(SCN)3↓ | |
| D. | 少量SO2通入NaClO溶液中:SO2+3ClO-+H2O═SO42-+Cl-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com