
【题目】一定条件下自然界存在如下反应:14CuSO4+5FeS2+l2H2O=7Cu2S+5FeSO4+12H2SO4,下列说法中不正确的是
A.Cu2S既是氧化产物又是还原产物
B.5molFeS2发生反应,有21mole—转移
C.CuSO4和FeS2是氧化剂,FeS2是还原剂
D.产物中的SO42—有一部分是氧化产物
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]A、B、C、D、E五种元素是周期表中前四周期的元素。只有A、B、C为金属且同周期,原子序数A<B<C。A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道。D原子最外层电子数是其周期序数的三倍。E能与D形成化合物ED2,可用于自来水的消毒。
(1)C的基态原子的价层电子排布式为_____;D和E的电负性大小关系为____(用元素符号表示)。
(2)化合物E2D分子的空间构型为____________________,中心原子采用_____________杂化。E与D还可形成三角锥结构的阴离子,该离子的化学式为_______,任意写出一种它的等电子体的化学式为____________。
(3)B与E能形成一种化合物BE4,其熔点:-25℃,沸点:l 36.4℃。则该化合物属于____晶体,晶体内含有的作用力类型有__________。
(4)A、B、D三种元素形成的某晶体的晶胞结构如图,则晶体的化学式为______。若最近的B与D的原子距离为a cm,该物质的摩尔质量为M g/mol,阿伏加德罗常数的数值为NA,则该晶体的密度为_________g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前Haber-Bosch法是工业合成氨的主要方式,其生产条件需要高温高压。为了有效降低能耗,过渡金属催化还原氮气合成氨被认为是具有巨大前景的替代方法。催化过程一般有吸附—解离—反应—脱附等过程,图示为N2和H2在固体催化剂表面合成氨反应路径的势能面图(部分数据略),其中“*”表示被催化剂吸附。
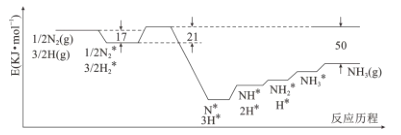
(1)氨气的脱附是____过程(填“吸热”或“放热”),合成氨的热化学方程式为_____
(2)合成氨的捷姆金和佩热夫速率方程式为 w= k1 p(N2)![]() -k2
-k2![]() ,w为反应的瞬时总速率,为正反应和逆反应速率之差,k1、k2是正、逆反应速率常数。合成氨反应N2+3H22NH3的平衡常数Kp=_________(用k1,k2表示)(注:Kp用各物质平衡分压来表示)。
,w为反应的瞬时总速率,为正反应和逆反应速率之差,k1、k2是正、逆反应速率常数。合成氨反应N2+3H22NH3的平衡常数Kp=_________(用k1,k2表示)(注:Kp用各物质平衡分压来表示)。
(3)若将2.0molN2和6.0molH2通入体积为1L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T2温度下n(H2)的变化,曲线B表示T1温度下n(NH3)的变化,T2温度下反应到a点恰好达到平衡。
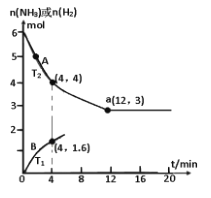
①温度T1___T2 (填“>”、“<”或“=”下同),T1温度下恰好平衡时,曲线B上的点为b(m, n ),则m___12,n__2。
②T2 温度下,反应从开始到恰好平衡时平均速率v(N2) =_____。
③T2温度下,合成氨反应N2+3H22NH3的平衡常数的数值是____;若某时刻,容器内气体的压强为起始时的80%,则此时v(正)____v(逆)(填“>”、“<”或“=”)。
(4)工业上通过降低反应后混合气体的温度而使氨气分离出来。这种分离物质的方法, 其原理类似于下列方法中的___(填序号)。
A.过滤 B.蒸馏 C.渗析 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述中,正确的是( )
A.戊烷有2种同分异构体
B.C8H10中只有3种属于芳香烃的同分异构体
C.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
D.CH3CH2CH2CH3光照下与氯气反应,只生成1种一氯代烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某物质X能发生如图转化(四种物质均含元素R),回答下列问题:

I.已知常温下Z为一种淡黄色固体,A的水溶液能与铝反应产生氢气,则:
(1)单质X的化学式为_________,工业上Z可以用于____________。(任写一种用途)
(2)A的水溶液与铝反应的离子方程式为_______________________________。
II.若X为一种常见金属单质,白色物质A在空气中易转化为红褐色。则:
(1)Z加入酸性KMnO4溶液中,溶液由紫色褪至无色,说明Z具有________性(填“氧化”、“还原”或“漂白”)。
(2)实验室制备A常会变质,检验其可能变质的方法是将其溶于足量的稀硫酸,然后加入试剂___________,为了较长时间观察A的颜色,可采取的措施有____________。(任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。 请回答该实验中的问题。
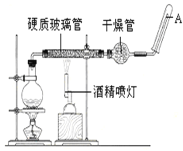
(1)写出该反应的化学方程式____________________。圆底烧瓶中盛装水,烧瓶里应事先放置____,其作用是_____。
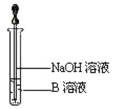
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;②取少量溶液B滴加KSCN溶液,溶液未变红色,该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图所示的操作,可观察到________________________________________ 的现象,请写出与上述现象相关的反应的化学方程式___________________________ ,____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。

(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,其中D与A、B、C均能形成原子个数比为1∶1与1∶2的两类化合物X、Y,E的某种含氧酸或含氧酸盐在一定条件下可分解生成D的单质。
(1)由上述条件可以确定的元素编号及对应元素名称是____________,其中原子间通过共用一对电子而形成的单质的电子式为________________,E能形成多种含氧酸,其中酸性最强的含氧酸的分子式为______________。
(2)若所有可能的X、Y中,C、D形成的是离子化合物,其中一种物质中含有两类化学键,那么另一种物质的形成过程用电子式可表示为______________________________________。
(3)若上述X、Y存在如下变化:X+Y→Z+D2,且X、Y中各原子(离子)最外层上均有8个电子,则该反应的化学方程式为__________________,反应物中存在非极性键的物质是__________,生成物中存在非极性键的物质是_____________,由此说明化学反应的本质是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com