
【题目】已知,向相同浓度的醋酸和盐酸中分别加入NaOH溶液,其pH与加入的NaOH溶液的体积变化关系分别如下图I、II所示。室温下,将xmol/L盐酸滴入VmLymol/L的碱溶液中,溶液pH和温度随加入盐酸体积变化曲线如下图III所示。
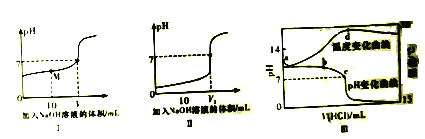
下列说法正确的是
A. 该碱溶液可能是Ba(OH)2溶液
B. c、d两点对应的盐酸体积不同
C. 从图中可判断x约为1, y小于1
D. d点后温度降低,是因为生成的盐发生水解吸热所致
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用三室式电解池(装置结构如图所示,电极均为惰性电极)可以实现用硫酸钠溶液制取硫酸和氢氧化钠。下列叙述正确的是

A. a气体为氢气,b气体为氧气
B. A为氢氧化钠溶液,B为硫酸溶液
C. 通电后中问隔室的SO42-向阴极迁移,阳极区溶液的pH增大
D. 该电解反应的方程式为2Na2SO4+6H2O![]() 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年12月初,华北大范围遭受今年以来最严重雾霾,环保监测中心研判,本次重污染与燃煤污染排放关系最为密切。开发新能源成为当前国际能源研究的重要课题,下列属于新能源的是( )
①天然气 ②生物质能 ③地热能 ④石油 ⑤太阳能 ⑥氢能
A. ①②③⑥ B. ②③④⑥ C. ③④⑤⑥ D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是( )

A.OC段离子反应方程式:H++OH-===H2O
B.溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+
C.溶液中n(NH![]() )=0.012 mol
)=0.012 mol
D.欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】外围电子构型为4f75d16s2的元素在周期表中位置应是哪一族( )
A.第4周期ⅦB族
B.第5周期ⅢB族
C.第6周期ⅦB族
D.第6周期ⅢB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。

(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为____________________极;
②电极b上发生的电极反应为____________________;
③列式计算电极b上生成的气体在标准状况下的体积:________________;
④电极c的质量变化是__________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:甲溶液______________________________;乙溶液______________________________;丙溶液______________________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? ________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,一种反应物过量,另一种反应物仍不能完全反应的是( )
A.过量的氢气与氮气
B.过量的浓盐酸与二氧化锰
C.过量的铜与浓硫酸
D.过量的锌与18 mol/L硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对于可逆反应N2(g) +3H2(g) ![]() 2NH3(g)(正反应放热)的下列叙述,不能说明反应已达化学平衡状态的是( )
2NH3(g)(正反应放热)的下列叙述,不能说明反应已达化学平衡状态的是( )
A. 恒容容器内混合气体的密度不再变化
B. NH3的生成速率与H2的生成速率之比为2:3
C. 恒压容器内混合气体的总物质的量不再变化
D. 单位时间内断裂a mol N三N键,同时断裂6amol N-H键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com