
【题目】用如图所示装置进行下列实验:将①中溶液逐滴滴入②中,预测的现象与实际相符的是
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
|
A. | 稀盐酸 | 浓碳酸钠溶液 | 立即产生气泡 | |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生大量红棕色气体 | |
C. | 氯化亚铁溶液 | 过氧化钠固体 | 产生气体和红褐色沉淀 | |
D. | 氢氧化钠溶液 | 氧化铝粉末 | 产生白色沉淀 |
A.AB.BC.CD.D
 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
【题目】硫化氢与浓硫酸发生如下反应:H2S+H2SO4(浓)→S↓+SO2↑+2H2O加热条件下,单质硫与浓硫酸又会发生如下反应:S+2H2SO4(浓)![]() 3SO2↑+2H2O
3SO2↑+2H2O
计算:
(1)若98%浓硫酸可表示为H2SO4aH2O,则a=__;若要把该浓硫酸转化为H2SO4H2O,则98%浓硫酸与加入水的质量比为_____。
(2)一定条件下,将0.1mol H2S气体通入足量浓硫酸中,生成b mol SO2,则 b的取值范围是_______。
(3)在50mL、4.0mol/L的NaOH溶液中,通入H2S气体并充分反应,然后,小心蒸发,得到不含结晶水的白色固体.通入H2S的物质的量为x mol,生成的白色固体的质量为7.9g,通过计算确定白色固体的可能成分及每种成分的质量(结果保留一位小数)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种常见物质的转化关系如图所示(部分反应物及产物略去),其中Q、M、N含有某种相同的元素。下列说法不正确的是
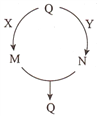
A. 若Q为N2,则X可能为氢气 B. 若Q为A1(OH)3,则Y可能为稀硫酸
C. 若Q为Fe,则Y可能为稀硝酸 D. 若Q为NaHCO3,则X可能为氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的Fe3O4。某学习小组为了研究烤蓝铁片,分别进行了以下实验操作:
①把一定量烤蓝铁片加工成均匀粉末。
②取m g该粉末,放入28.00 mL 1 mol/L的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。
③再取三份不同质量的粉末,分加加到相同体积(V)、物质的量浓度均为l0.00 mol/L的三份硝酸溶液中,充分反应后,固体全部溶解,有关的实验数据如下表所示(假设NO是硝酸的唯一还原产物):
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入粉末质量/g | 13.68 | 27.36 | 34.20 |
生成气体的体积(标准状况)/L | 2.912 | 5.824 | 6.720 |
完成下列各题:
(1)实验②所得溶液中的溶质是_______(写化学式),样品中n(Fe)∶n(Fe3O4)=________,m=____________。
(2)计算实验③中每份硝酸溶液的体积(V)(mL)_________。
(3)若向实验Ⅱ所得溶液中继续加入铜粉,要使溶液中Cu2十、Fe2+、Fe3+同时存在,求加入铜粉的物质的量的范围___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对二甲苯(PX)可发生如下反应生成对苯二甲酸(PTA)。下列有关说法错误的是
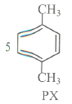 +12MnO4-+36H+
+12MnO4-+36H+![]()
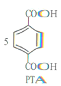 +12Mn2++28H2O
+12Mn2++28H2O
A.PTA是该反应的氧化产物B.消耗1molPX,共转移8mol电子
C.PX含苯环的同分异构体还有3种D.PTA与乙二醇可以发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法测得其中含C 72.0%、H 6.67%,其余为氧;质谱法分析得知A的相对分子质量为150。现代仪器分析有机化合物的分子结构有以下两种方法。
方法一:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1∶2∶2∶2∶3。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如图:
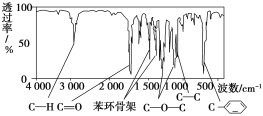
已知:A分子中只含一个苯环,且苯环上只有一个取代基。试回答下列问题。
(1)A的分子式为________。
(2)A的结构简式为_______________________________________________(写一种即可)。
(3)A的芳香化合物类同分异构体有多种,其中分子中不含甲基的芳香酸为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4,暗紫色固体),是一种新型、高效、多功能的水处理剂。完成下列填空:
(1)K2FeO4溶于水得到浅紫红色的溶液,且易水解,生成氧气和氢氧化铁。写出该水解反应的离子方程式_________;说明高铁酸钾做水处理剂的原理______。
(2)下图分别是1mol/L的K2FeO4溶液在不同pH和温度下c(FeO42-)随时间的变化曲线。
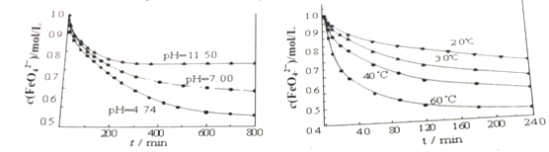
根据以上两图,说明配制K2FeO4溶液的注意事项______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO![]() )=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为0.2 mol·L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及物质未标出)。

(1)已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)===2CO(g)+4H2(g)的ΔH=______________。
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
| 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
①用H2表示前2 h 的平均反应速率v(H2)=_________________________________;
②该温度下,CO2的平衡转化率为________。
(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①该反应的ΔH________0(填“>”或“<”)。
②曲线c表示的物质为_______。
③为提高H2的平衡转化率,除改变温度外,还可采取的措施______________。(答出一条即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com