
根据右表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )

A.c(HCO3-)>c(ClO-)>c(OH-)
B.c(ClO-)>c(HCO3-)>c(OH-)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
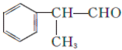 的物质,该物质是一种香料.请根据下述路线,回答下列问题:
的物质,该物质是一种香料.请根据下述路线,回答下列问题: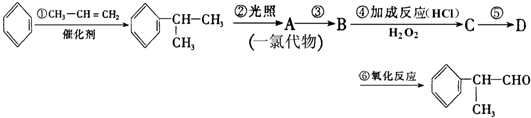
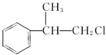 或
或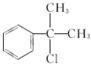 .
. (有机物写结构简式,并注明反应条件).
(有机物写结构简式,并注明反应条件).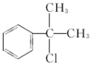 的水解产物
的水解产物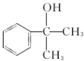 羟基直接相连的碳原子上没有氢原子,不能被氧化,会降低产率.
羟基直接相连的碳原子上没有氢原子,不能被氧化,会降低产率.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
一定量的甲烷在O2不足的情况下燃烧,得到CO、CO2和H2O的总质量为14.4 g,若其中水的质量为7.2 g,则CO的质量是( )
A.2.8g B.4.4g C.5.6g D.在2.8 g~5.6 g之间
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.乙烯的电子式为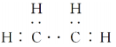
B.乙烯的球棍模型为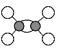
C.乙烯分子是平面结构
D.乙烯的结构简式为CH2CH2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
常温时,下列混合溶液的pH 一定小于7的是( )
A.pH = 3的盐酸和pH = ll的氨水等体积混合
B.pH = 3的盐酸和pH = 11的氢氧化钡溶液等体积混合
C.pH = 3的硫酸和pH = ll的氨水等体积混合
D.pH = 3的醋酸和pH = ll的氨氧化钡溶液等体积混合
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
下列有关AgCl沉淀的溶解平衡的说法中正确的是( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度减小
D.在有AgCl沉淀生成的溶液中加入NaCl固体,AgCl沉淀溶解的量不变
查看答案和解析>>
科目:高中化学 来源:2017届江西省鹰潭市高三上学期第四次月考化学试卷 题型:选择题
下图表示铁与不同浓度硝酸反应时,各种还原产物的相对含量与硝酸溶液浓度的关系,则下列说法不正确的是
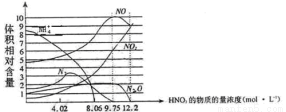
A.一般来说,硝酸与铁反应的还原产物不是单一的
B.用一定量的铁粉与大量的9.75mol·L—1HNO3溶液反应得到标态下气体2.24L,则参加反应的硝酸的物质的量为0.1mol.
C.硝酸的浓度越大,其还原产物中价态越高的成份越多
D.当硝酸浓度为9.75mol·L—1时还原产物是NO、NO2、N2O,且其物质的量之比为5:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com