
【题目】实验室制备1,2-二溴乙烷的反应原理如下:

用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:

有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸
c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量副产物乙醚.可用 的方法除去;
若产物中有少量未反应的Br2,最好用 洗涤除去;
a.水 b.氢氧化钠溶液
c.碘化钠溶液 d.乙醇
(6)下列关于装置的说法正确的是 ;
a.A的滴液漏斗的侧面导管有利于液体顺利滴落
b.B的长导管可防止反应出现堵塞情况
c.B有防倒吸作用
(7)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
【答案】
(1)d;(2)c;
(3)溴的颜色完全褪去;
(4)下;(5)蒸馏,b ;(6)abc;
(7)避免溴大量挥发;产品1,2-二溴乙烷的凝固点低,过度冷却会凝固而堵塞导管。
【解析】
试题分析:(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水,生成乙醚,故答案为:d;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,故答案为:c;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,故答案为:溴的颜色完全褪去;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,故答案为:下;
(5)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离;常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,故答案为:蒸馏;b;
(6)a.A的滴液漏斗的侧面导管使滴液漏斗液面上方的压强与装置内压强相等,有利于液体顺利滴落,正确;b.如果反应出现堵塞,B的长导管中的液面将上升,正确;c.如果出现倒吸,外界空气可以从B进入装置,从而防倒吸,正确;故选abc;
(7)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,故答案为:乙烯与溴反应时放热,冷却可避免溴的大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】下列广告语在科学性上没有错误的是( )
A. 没有水就没有生命
B. 这种饮料不含任何化学物质
C. 这种纯净水绝对纯净,不含任何离子
D. 这种口服液含有丰富的N、P、Zn等微量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
B.原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀
C.钢铁电化学腐蚀的两种类型主要区别在于水膜的酸性不同,引起的正极反应不同
D.无论哪种类型的腐蚀,其实质都是金属被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】部分果蔬中含有下列成分:
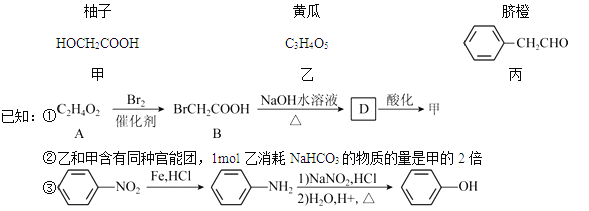
回答下列问题:
(1)甲可由已知①得到。
①甲中含有不饱和键的官能团名称为 ,可以表征有机化合物中存在何种官能团的仪器是 。
②A→B为取代反应,A的结构简式为 。
③B→D的化学方程式为 。
(2)乙在一定条件下能聚合生成链状酯类有机高分子化合物,该反应的化学方程式为_____________。
(3)由丙经下列途径可得一种重要的医药和香料中间体J(部分反应条件略去):
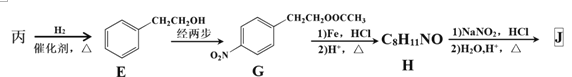
检验丙中官能团的试剂是 ,反应的现象是________________。
②经E→G→H保护的官能团是 ,据此推出E→G两步反应略去的反应物可能为:第一步__________________,第二步____________________。
③J有多种同分异构体。其中某异构体L呈链状且不存在支链,L中的官能团都能与H2 发生加成反应,L在核磁共振氢谱上显示为两组峰,峰面积比为3:2,则L的结构简式为___________(只写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列4种重要的有机物:①CH3CH2CHO②![]() ③
③![]() ④
④![]() .
.
请回答:
(1)能与银氨溶液反应生成丙酸铵的是 (填序号).
(2)能与浓硝酸反应生成TNT的是 (填序号).
(3)能与甲醛在酸催化下相互缩合成高分子化合物的是 (填序号).
(4)写出②与NaOH的乙醇溶液共热生成丙烯的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图两个电解槽中,A、B、C、D均为石墨电极。若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )
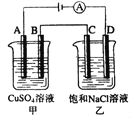
A. 甲烧杯中A极上最多可析出铜0.64g
B. 甲烧杯中B极上电极反应式4OH--4e-= 2H2O+O2↑
C. 乙烧杯中滴入酚酞试液,D极附近先变红
D. 烧杯中C极上电极反应式为4H+ + 4e-=2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞内元素和化合物的叙述,正确的是
A. 组成细胞的主要元素中含量最多的是碳
B. 精瘦肉细胞中含量最多的化合物是蛋白质
C. 在人的一生中,细胞中的自由水/结合水的比值逐渐上升
D. 多糖、蛋白质、核酸等是以碳链为骨架的生物大分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有灼烧了一段时间的碳酸钙样品16g,将其溶于足量的水中,向其中通入适量的二氧化碳,过滤,再次将所得的固体灼烧至质量不变,所得固体质量11.2g,则原固体混合物中钙元素的质量分数为 ()
A.50%B.40%C.60%D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所含分子数由多到少的排列顺序是 (用字母排序)
A.标准状况下33.6LH2
B.所含电子的物质的量为4mol的H2
C.20℃时45gH2O
D.常温下,16gO2与14gN2的混合气体
E.含原子总数约为1.204×1024的NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com