
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制铵明矾晶体的工艺流程如图所示:
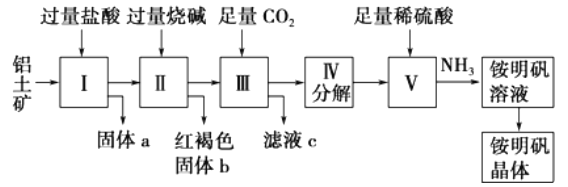
请回答下列问题:
(1)固体a的化学式为____,固体b化学式为____,Ⅲ中通入足量CO2气体发生反应的离子方程式为________________.
(2)由Ⅴ制取铵明矾溶液的化学方程式为______________.
(3)由I→II→III→IV都要用到的分离方法是______,由铵明矾溶液中制铵明矾晶体的操作是______________.
(4)如果先向铝土矿加入过量氢氧化钠,再加入过量盐酸,此时首先出现的固体a是__.
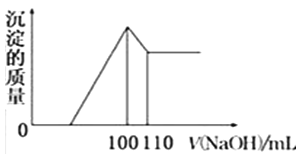
(5)向10gFe2O3、SiO2和Al2O3的混合物中,加入100ml稀硫酸,过滤后,向滤液中加入10mol/L NaOH溶液,产生沉淀的质量和加入NaOH溶液体积的关系曲线如图所示.则混合物中三氧化二铝的质量分数为______.
【答案】 SiO2 Fe(OH)3 AlO2﹣+CO2+2H2O═HCO3﹣+Al(OH)3↓ Al2O3+4H2SO4+2NH3═2NH4Al(SO4)2+3H2O 过滤 蒸发浓缩、冷却结晶、过滤洗涤 Fe2O3 51%
【解析】(1)铝土矿中Al2O3和Fe2O3能溶于盐酸,SiO2不溶于盐酸,所以固体a的化学式为SiO2,固体b化学式为: Fe(OH)3 ;Al2O3溶于烧碱生成NaAlO2溶液,在其中通入CO2生成Al(OH)3 沉淀,故答案为:SiO2; AlO2-+CO2+2H2O═HCO3-+Al(OH)3 ↓;(2)由Ⅴ制取铵明矾溶液的化学方程式为Al2O3+4H2SO4+2NH3═2NH4Al(SO4)2+3H2O ;(3)由I→II→III→IV都要用到的分离方法是过滤,由铵明矾溶液中制铵明矾晶体的操作是蒸发浓缩、冷却结晶、过滤洗涤;(4)如果先向铝土矿加入过量氢氧化钠,Fe2O3与过量氢氧化钠不反应,此时首先出现的固体a是Fe2O3; (5)加入盐酸体积100mL~110mL时,发生的反应是Al(OH)3+OH―=AlO2―+2H2O,可知n(Al(OH)3 )=n(NaOH)=0.01L×10mol/L=0.1mol,则n(Al2O3)=0.05mol,m(Al2O3)=0.05mol×102g/mol=5.1g,则混合物中三氧化二铝的质量分数为![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列有关纯碱和小苏打的叙述中正确的是 ( )
A. Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠溶液反应
B. 等质量Na2CO3、NaHCO3分别与相同浓度的盐酸反应,NaHCO3消耗的盐酸体积少
C. 向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而Na2CO3溶液中加入Ba(OH)2溶液出现白色沉淀
D. 等物质的量Na2CO3、NaHCO3分别与足量稀H2SO4反应,NaHCO3产生的CO2多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,HNO3既表现酸性又表现出氧化性的是
A. 使紫色石蕊溶液变红 B. 与铜反应
C. 与Na2CO3溶液反应 D. 与S单质混合共热时生成H2SO4和NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用下图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体VmL。下列说法正确的是

A.铜电极连接电源正极
B.黑色粉末X是铁粉
C.铜的相对原子质量的计算式是![]()
D.石墨电极上发生的反应是4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
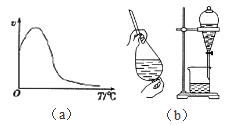
【题目】下列说法不正确的是
A. 溶液、胶体和悬浊液这三种分散系的本质区别是能否透过滤纸或半透膜
B. 仅用新制的氢氧化铜悬浊液一种试剂可鉴别乙醇、乙酸、乙酸乙酯、葡萄糖溶液(必要时可加热)
C. 过氧化氢在酶作用下的分解反应速率随温度的变化关系如图(a)所示
D. 在实验中从溴水中分离出溴,先加入少量CCl4, 可选用的操作、装置如图(b)所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 电解精炼铜,当外电路通过NA个电子时;阳极质量减少32 g
B. 反应3H2(g)+N2(g) ![]() 2NH3(g) △H=-92kJ·mol-1,当放出热量 9.2 kJ时,转移电子0.6 NA
2NH3(g) △H=-92kJ·mol-1,当放出热量 9.2 kJ时,转移电子0.6 NA
C. lmol·L-1的氯化铜溶液中,若Cl-的数目为2Na,则Cu2+的数目为Na
D. 标准状况下,NO和O2各11. 2L混合充分反应,所得气体的分子总数为0.75 Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 标准状况下,11.2LSO2气体中含氧原子数等于18g水中含有的氧原子数
B. 5.6 g铁与足量稀硫酸反应失去的电子的物质的最为0.3 mol
C. 100g98%的浓硫酸所含的氧原子个数为4mol
D. 20gNaOH溶于1L水,所得溶液中c(Na+)=0.5mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com