
取一定量的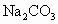 、
、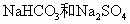 的混合物与
的混合物与 过量盐酸反应,生成
过量盐酸反应,生成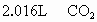 (标准状况),然后加入500mL
(标准状况),然后加入500mL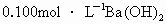 溶液,得得沉淀的质量为2.33g,溶液中过量的碱用10.0mL
溶液,得得沉淀的质量为2.33g,溶液中过量的碱用10.0mL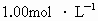 盐酸恰好完全中和.计算混合物中各物质的质量.
盐酸恰好完全中和.计算混合物中各物质的质量.
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源:2012届上海市十校高三第二次联考化学试卷 题型:填空题
某同学取一定量的Al和Fe固体混合物,与2.0 L极稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题: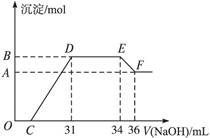
1、图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 。
在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 ;上述现象说明溶液中______________结合OH-的能力比___________强(填写离子符号)。
2、B与A的差值为______________mol。
3、B点对应的沉淀的物质的量为____________mol,C点对应的氢氧化钠溶液的体积为______________mL。
4、求原硝酸溶液的物质的量浓度?
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市十校高三第二次联考化学试卷 题型:填空题
某同学取一定量的Al和Fe固体混合物,与2.0 L极稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
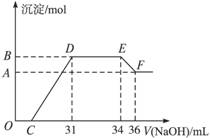
1、图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 。
在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为
;上述现象说明溶液中______________结合OH-的能力比___________强(填写离子符号)。
2、B与A的差值为______________mol。
3、B点对应的沉淀的物质的量为____________mol,C点对应的氢氧化钠溶液的体积为______________mL。
4、求原硝酸溶液的物质的量浓度?
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 1 | 2 | 3 | 4 | 5 |
| HNO3溶液的体积(mL) | 100 | 200 | 300 | 400 | 500 |
| 剩余固体质量(g) | 17.2 | 8 | 0 | 0 | 0 |
| 气体体积(L) | 2.24 | 4.48 | 6.72 | 7.84 | 7.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
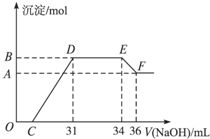 某同学取一定量的Al和Fe固体混合物,与2.0L极稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
某同学取一定量的Al和Fe固体混合物,与2.0L极稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 镁、铝、铁及其化合物在生产和生活中有广泛的应用.
镁、铝、铁及其化合物在生产和生活中有广泛的应用.| 实验序号 | I | II | III |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com