
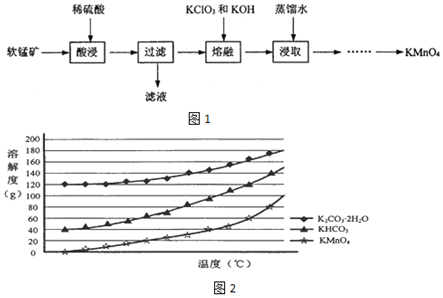
分析 以软锰矿(主要成分为MnO2,还有少量FeO、Fe2O3、MgO和Al2O3杂质)为原料制备高锰酸钾的流程:由流程可知,加硫酸溶解后,FeO、Fe2O3、MgO和Al2O3杂质溶于硫酸,FeO+2H+=Fe2++H2O、Fe2O3+6H+=2Fe3++3H2O、MgO+2H+=Mg2++H2O、Al2O3+6H+=2Al3++3H2O,MnO2不溶,过滤得到MnO2,加入KC1O3、KOH,MnO2被KC1O3氧化成K2MnO4,发生反应:3MnO2+KC1O3+6KOH$\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O,加入蒸馏水浸取,向浸取液中缓缓通入CO2,再调节pH≈12.3,过滤,将滤液蒸发浓缩,冷却结晶,过滤,洗涤,低温供干得K2MnO4晶体,以此分析来解答.
解答 解:(1)“酸浸”需要加热的目的是加快反应速率,此过程中发生反应的离子方程式有:FeO+2H+=Fe2++H2O、Fe2O3+6H+=2Fe3++3H2O、MgO+2H+=Mg2++H2O、Al2O3+6H+=2Al3++3H2O,
故答案为:加快反应速率;FeO+2H+=Fe2++H2O或 Fe2O3+6H+=2Fe3++3H2O或MgO+2H+=Mg2++H2O或Al2O3+6H+=2Al3++3H2O;
(2)①“熔融”过程中,MnO2被KC1O3氧化成K2MnO4,发生反应:3MnO2+KC1O3+6KOH$\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O;
故答案为:3MnO2+KC1O3+6KOH$\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O;
②为了提高MnO2利用率,KC1O3自身会分解,故加入KC1O3应过量;
故答案为:KC1O3自身会分解;
③加热熔融物含有强碱KOH应用铁坩埚;
故答案为:b;
(3)已知::①MnO42-只存在于强碱环境(pH>13.5)中,当pH降低时,MnO42-会歧化为MnO4-和MnO2;②饱和碳酸钾溶液的pH约为12.3,饱和碳酸氢钾溶液的pH约为8.8;③由溶解度曲线图2可知:温度较低时,K2MnO4溶解度随温度升高而升高,故要低温烘干,
则由浸取液制备KMnO4晶体的实验方案为:向浸取液中缓缓通入CO2,再调节pH≈12.3,过滤,将滤液蒸发浓缩,冷却结晶,过滤,洗涤,低温供干得K2MnO4晶体;
故答案为:至pH≈12.3,过滤,将滤液蒸发浓缩,冷却结晶,过滤,洗涤.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 达到平衡后再充入少量X气体,上述反应的△H增大 | |
| B. | 达到平衡时,反应速率v正(X)=2v逆(Z) | |
| C. | 达到平衡后,降低温度,正向反应速率大于逆向反应速率 | |
| D. | 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH+HCl | B. | Ba(OH)2+H2SO4 | C. | Fe(OH)3+HNO3 | D. | KOH+H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN的结构式:H-C≡N | |
| B. | HClO的电子式: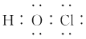 | |
| C. | 质子数为86、中子数为51的铯原子:86137Cs | |
| D. | S2-的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中含有的碳碳双键数为NA | |
| B. | 混合气体中含有的碳原子数为2NA | |
| C. | 当混合气体完全燃烧时,消耗O2的分子数为3NA | |
| D. | 当混合气体完全燃烧时,转移的电子数为12NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
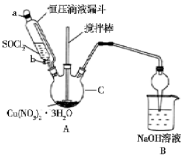 硝酸铜是一种重要的化工原料,实验室以含铁的铜屑为原料制备硝酸铜的过程如下,请按要求回答问题
硝酸铜是一种重要的化工原料,实验室以含铁的铜屑为原料制备硝酸铜的过程如下,请按要求回答问题| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z元素的原子最外层有3个电子 |
| W | W的一种核素的质量数为28,中子数为14 |
| A. | W原子半径大于Z | |
| B. | 氢元素可以与X、Y分别形成的二元化合物分子间容易形成氢键 | |
| C. | 向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量无现象 | |
| D. | W的单质与氢氟酸反应生成两种无色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com