
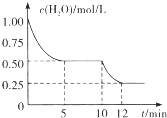
 在2L密闭容器中进行反应C(s)+H2O(g)=CO(g)+H2(g )△H>0,测得
在2L密闭容器中进行反应C(s)+H2O(g)=CO(g)+H2(g )△H>0,测得| A. | 0-5 min内,v(H2)=0.05 mol/(L.min) | |
| B. | 5 min时该反应的K值一定小于12 min时的K值 | |
| C. | 10 min时,改变的外界条件可能是减小压强 | |
| D. | 5 min时该反应的v正大于11 min时的v逆 |
分析 A.根据图可知,前5min内H2O的浓度由1.00mol/L减小为0.50mol/L,根据v=$\frac{△c}{△t}$计算c(H2O),再利用速率之比等于化学计量数之比计算v(H2);
B.由图可知,10min时H2O的浓度继续减小,反应向正反应方向移动,并且10min后反应速率大于前5分钟,则不是升压就是升温,平衡常数仅与温度有关;
C.由图可知,10min时H2O的浓度继续减小,反应向正反应方向移动;
D.根据B的判断,11 min时的温度高于5min时,根据温度越高反应速率越快.
解答 解:A.根据图可知,前5min内H2O的浓度由1.00mol/L减小为0.50mol/L,根据v=$\frac{△c}{△t}$=$\frac{1mol/L-0.5mol/L}{5min}$=0.1mol/(L•min),由化学计量数之比等于反应速率之比,则v(H2)=0.1mol/(L•min),故A错误;
B.由图可知,10min时H2O的浓度继续减小,反应向正反应方向移动,该反应正反应是吸热反应,所以是升高温度,所以5 min时该反应的K值一定小于12 min时的K值,故B正确;
C.由图可知,10min时H2O的浓度继续减小,反应向正反应方向移动,该反应正反应是吸热反应,所以是升高温度,故C错误;
D.根据B的判断,11 min时的温度高于5min时,根据温度越高反应速率越快,所以5 min时该反应的v正小于11 min时的v逆,故D错误;
故选B.
点评 本题考查化学平衡图象,涉及反应速率的计算、化学平衡的影响因素、化学平衡状态本质,难度中等,注意根据浓度变化判断可能改变的条件.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③中的氧化产物分别是I2、Fe3+、CoCl2 | |
| B. | 根据以上方程式可以得到氧化性Cl2>Fe3+>Co2O3 | |
| C. | 在③反应中当1molCo2O3参加反应时,2molHCl被氧化 | |
| D. | 可以推理得到Cl2+FeBr2═FeCl2+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.6mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知甲、乙、丙、丁、戊、己六种物质中含同一种元素,它们之间的转化关系如图所示.其中,丁是一种红褐色沉淀,戊是一种白色沉淀.请回答下列问题:
已知甲、乙、丙、丁、戊、己六种物质中含同一种元素,它们之间的转化关系如图所示.其中,丁是一种红褐色沉淀,戊是一种白色沉淀.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①②③④ | B. | ②③①④ | C. | ②①③④ | D. | ③②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO3-,Cl-,K+ | B. | ClO-,Cl-,H+ | ||
| C. | NaClO,NaClO3,NaNO3 | D. | NaClO,Na2SO4,NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含0.1 mol Na+、0.2 mol Mg2+、0.1 mol Cl-和0.1 mol NO3-的溶液 | |
| B. | 只含0.1 mol NH4+、0.1 mol Ca2+、0.1 mol CO32-和0.1 mol Cl-的溶液 | |
| C. | 为了通过测定pH的大小,达到比较HCl和CH3COOH酸性强弱的目的,分别配制100 mL 0.1 mol/L的NaCl溶液和CH3COONa溶液 | |
| D. | 仅用1 000 mL的容量瓶、烧杯、玻璃棒、量筒、58.5 g NaCl固体和水配制1 L 1 mol/L的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com