
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,3.2 g O2所含氧原子的数目为0.2 NA | |
| B. | 含有NA个阴离子的Na2O2与足量水反应,转移电子数为2NA | |
| C. | 标准状况下,等体积的水和CO2,含有的氧原子数目为1:2 | |
| D. | 1L 1mol/L饱和FeCl3滴入沸水中完全水解生成Fe(OH)3胶体粒子个数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相同的①CH3COONa、②NaHCO3、③ 三份溶液中的c(Na+):③>②>① 三份溶液中的c(Na+):③>②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| C. | Na2CO3和NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | 等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:2c(K+)=c(X-)+c(HX) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
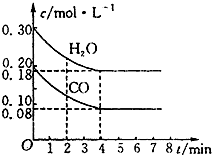 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.CO和H2O的浓度变化如图所示(850℃时物质浓度的变化),则0~4min的平均反应速率v(CO)=0.03mol•L-1•min-1.
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.CO和H2O的浓度变化如图所示(850℃时物质浓度的变化),则0~4min的平均反应速率v(CO)=0.03mol•L-1•min-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ICl与水反应可生成 HCl 和 HIO,则1mol ICI 参加反应转移电子为 1mol | |
| B. | 某温度下液态IF5发生电离:2IF5?IF4++IF6-,一定有c (IF4+)×c (IF6-)=c (IF5) | |
| C. | BrCl与Mg反应生成MgCl2和MgBr2 | |
| D. | XYn与卤素单质一样都是非极性分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com