
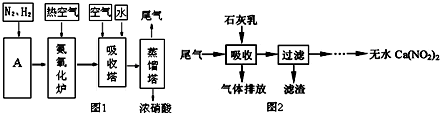
分析 (1)工业上采用氨氧化法制硝酸.首先N2和H2在合成塔中合成NH3,然后在氧化炉中将NH3氧化为NO2,在吸收塔中NO2与O2、H2O反应生成HNO3,最后稀HNO3在蒸馏塔中浓缩制得浓硫酸;
(2)分离空气中氮气的方法:先液化空气,然后采用蒸馏或控制氮气的沸点加热蒸发分离出氮气;
(3)工业制硝酸的尾气处理,主要采用碱性石灰乳吸收NO和NO2,滤渣中的石灰乳可回收利用,既经济合理,又绿色环保;
(4)硝酸工业尾气NO、NO2用碱液吸收的主反应为NO+NO2+2OH-=2NO2-+H2O,副反应为2NO2+2OH-=NO2-+NO3-+H2O.要控制NO、NO2的比例为1:1,才能保证主反应完全反应.若NO过量,NO不能得到充分的吸收;若NO2多了,副反应就会生成Ca(NO3)2.
解答 解:(1)N2与H2合成氨是在合成塔中进行的.其中N2的制备,是将空气液化,然后进行蒸馏或者控制N2沸点加热蒸发制得;反应物和条件题干已经给出,只需写出生成物、配平反应方程式为CH4+H2O(g)$\frac{\underline{\;催化剂\;}}{\;}$CO+3H2,
故答案为:合成塔;液化;蒸馏或控制N2的沸点加热蒸发;CH4+H2O(g)$\frac{\underline{\;催化剂\;}}{\;}$CO+3H2;
(2)设c(H2O):c(CO)为X.假设初始c(H2O)为X,则c(CO)为.由CO(g)+H2O(g)═CO2(g)+H2(g)可知,要使CO转化率达到0.8,则平衡时各物质的浓度为c(CO)=0.2; c(H2O)=X-0.8;c(CO2)=0.8;c(H2)=0.8.由平衡常数K=$\frac{0.8×0.8}{(X-0.8)×0.2}=0.64$,可解得X=5.8,
故答案为:5.8;
(3)使用吸收塔的好处就在于,增大尾气与吸收液之间接触的面积,从而提高尾气的吸收率.滤渣中可回收利用的是过量的石灰乳,也就是Ca(OH)2.
故答案为:使尾气中的NO、NO2 被充分吸收;Ca(OH)2;
(4)硝酸工业尾气NO、NO2一般用碱液吸收,主反应为:NO+NO2+2OH-=2NO2-+H2O,副反应为:2NO2+2OH-=NO2-+NO3-+H2O.若n(NO):n(NO2)>1:1,则一氧化氮过量,排放气体中NO含量升高;若n(NO):n(NO2)<1:1,则二氧化氮过量,二氧化氮与石灰乳反应生成Ca(NO3)2,
故答案为:排放气体中NO含量升高;产品Ca(NO2)2中Ca(NO3)2含量升高.
点评 本题主要考察硝酸工业生产中尾气的处理问题,契合我国当前绿色生产的理念,此类问题近期考察频率很高.


科目:高中化学 来源: 题型:选择题
| A. | 鸡蛋白溶液中分散质的微粒直径在1~100 nm之间 | |
| B. | 当日光从窗隙射入暗室时,可观察到一束光线 | |
| C. | 向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀 | |
| D. | 在河流入海处易形成沙洲 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2 | B. | N2O | C. | N2O4 | D. | N2O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
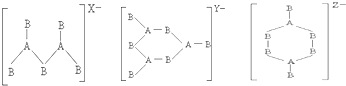
| A. | 2,3,4 | B. | 4,3,2 | C. | 4,2,3 | D. | 3,2,4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂和蛋白质都能发生水解反应 | |
| B. | 淀粉、纤维素、蛋白质都属于天然有机高分子化合物 | |
| C. | 采用多次盐析和溶解,可以分离提纯蛋白质 | |
| D. | 一般情况下,天然油脂都可以发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com