
是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
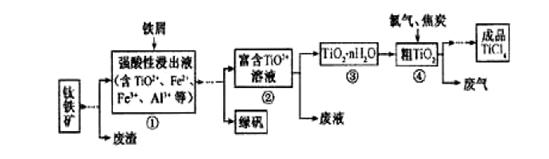
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe === 3Fe2+
2TiO2+(无色) +Fe+4H+ === 2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色) +Fe3++H2O === TiO2+(无色) +Fe2++2H+
加入铁屑的作用是____________。
(2)在②→③工艺中需要控制条件以形成TiO2·n H2O溶胶,该分散质颗粒直径大小在_____________范围。
(3)若把③中制得的固体TiO2·n H2O用酸清洗除去其中的Fe (OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe (OH)3+3H+ Fe3+ +H2O的
Fe3+ +H2O的 平衡常数K=_____________。
平衡常数K=_____________。
(4)已知:TiO2 (s) +2 Cl2 (g)=== TiCl4(l) +O2(g) △H=+140KJ·mol-1
2C(s) +O2(g)=== 2CO(g) △H=—221KJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:_____________。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________(只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4 ,可采用_____________方法。
| TiCl4 | SiCl4 | |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
【解析】(1)根据题意给出方程式分析铁屑的作用就是作为还原剂的,即:将Fe3+还原为Fe2+,另外浸出液显紫色,说明含有Ti3+,防止Ti3+被Fe3+氧化成TiO2+。参考答案中“生成Ti3+保护Fe2+不被氧化。”有点让人费解,能不能说成“防止Ti3+被Fe3+氧化成TiO2+”或者说“将TiO2+还原成Ti3+” 。
。
(2)形成TiO2·n H2O溶胶,说明得到是胶体,其分散质颗粒直径大小为10-9~10-7m(或1nm~100nm);
(3)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH—)=2.79×10—39,25℃时,c(H+)×c(OH—)=Kw=1×10—14;反应Fe (OH)3+3H+ Fe3+ +H2O的平衡常数K=
Fe3+ +H2O的平衡常数K=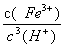 =
=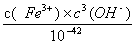 =
=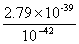 =2.79×103。
=2.79×103。
此问设计精妙!利用数学关系巧妙代换求出反应的平衡常数,命题者的独具匠心可见一斑。
(4)涉及盖斯定律计算,比较常规,按要求写出方程式相加即可得出【答案】
TiO2(s)+ 2C(s)+2Cl2 (g)=TiCl4(l)+2CO(g) △H=—81KJ·mol-1
(5)依据绿色化学理念,该工艺流程中存在的不足之处产生了废气,废液,废渣等。
(6)下表信息可以看出,SiCl4、TiCl4两者的沸点相差较大,要精制含少量SiCl4杂质的TiCl4可用蒸馏(或分馏)等方法。
这题是典型的化工流程题,问题设置不难。第(3)小问是亮点,精妙!个人觉得加上请计算该反应的平衡常数K可能设问更清晰。
【答案】(1)使Fe3+还原为Fe2+;生成Ti3+保护Fe2+不被氧化。
(2)10-9m~10-7m(或其他合理答案);
(3)2.79×103;
(4)TiO2(s)+ 2C(s)+2Cl2 (g)=TiCl4(l)+2CO(g) △H=—81KJ·mol-1;
(5)产生三废(或其他合理答案);
(6)蒸馏(或分馏,或精馏)。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
下列文字表述与反应方程式对应且正确的是( )
|
| A. | 用浓硫酸与4﹣溴﹣1﹣丁醇加热发生消去反应:BrCH2CH2CH2CH2OH |
|
| B. | 羟基乙酸催化缩聚得PGA:nHOCH2COOH |
|
| C. | 水杨酸( |
|
| D. | 丙烯与HCl加成产物可生成两种有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
福岛核电站泄漏的放射性物质中含有 I,下列有关
I,下列有关 I的说法正确的是( )
I的说法正确的是( )
|
| A. |
|
|
| B. | 由此可确定碘元素的相对原子质量为131 |
|
| C. |
|
|
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学通过系列实验探究Mg及其化合物的性质, 操作正确且能达到目的的是
操作正确且能达到目的的是
A、将水加入浓硫酸中得到稀硫酸,置镁片于其中探究讨Mg的活泼性
B、将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成
C 、将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
、将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
D、将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。
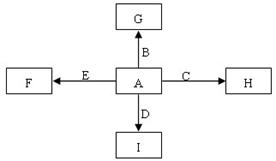
已知:
① 反应 能放出大量的热,该反应曾应用于铁轨的焊接;
能放出大量的热,该反应曾应用于铁轨的焊接;
② I是一种常见的温室气体,它和 可以发生反应:2E+I
可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为____________________________________________;
(2)化合物Ⅰ的电子式为______________________,它的空间构型是_________;
(3)1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量(写出离子方 程式和计算过程);
程式和计算过程);
(4)C与过量NaOH溶液反应的离子方程式为___________________________,反应后溶液与过量化合物Ⅰ反应的离子方程式为_______________________________;
(5)E在I中燃烧观察到的现象是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL 0.1 mol·L-1 AlCl3溶液,两烧杯中都有沉淀生成。下列判断正确的是
A.甲中沉淀一定比乙中的多 B.甲中沉淀可能比乙中的多
C.甲中沉淀一定比乙中的少 D.甲中和乙中的沉淀可能一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
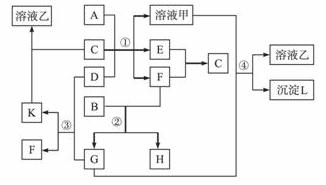
(1)A、B、C、D代表的物质分别为__________、__________、__________、__________(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是______________________________;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是________、_________(填化学式);
(4)反应③产物中K的化学式为____________________;
(5)反应④的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学式是______________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是___________________,此液体具有的性质是______(填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生 成
成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为________。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是_______________________________。
mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com