
| A. | 沼气和液化石油气都是可再生能源 | |
| B. | 煤经气化、液化和干馏三个物理变化过程,可变为清洁能源 | |
| C. | PM 2.5含有的铅、铬、砷等对人体有害的元素均是重金属元素 | |
| D. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白体发生变性 |
分析 A、在自然界中可以不断再生、永续利用的能源,具有取之不尽,用之不竭的特点,主要包括太阳能、风能、水能、生物质能、地热能和海洋能等;
B、煤的气化、液化、干馏都是化学变化;
C、砷是非金属元素;
D、酒精能使蛋白质变性.
解答 解:A、沼气是可再生能源,液化石油气不是可再生能源,故A错误;
B、煤的气化是煤在氧气不足的条件下进行部分氧化形成H2、CO等气体的过程.煤的液化是将煤与H2在催化剂作用下转化为液体燃料或利用煤产生的H2和CO通过化学合成产生液体燃料或其他液体化工产品的过程,煤的干馏是指煤在隔绝空气的条件下加热,生成煤焦油、焦炭、焦炉煤气等物质,属于化学变化,将煤进行深加工后,脱硫处理、气化处理很好地减少污染气体排放,提高燃烧效率,故B错误;
C、PM 2.5中含有的铅、铬、砷等对人体有害的元素,其中铅、铬是重金属元素,砷是非金属元素,故C错误;
D、医药中常用酒精来消毒,是因为酒精能够使细菌蛋白体发生变性,故D正确;
故选D.
点评 本题主要考查在生活和生产中常见物质的性质和用途,是化学应用于生活的题型训练,题目难度不大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
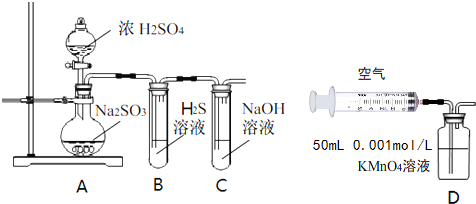
| 实验步骤 | 实验操作 | 预期现象与结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
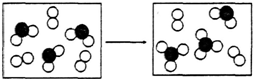 A、B、C、D、E、F是原子序数依次增大的短周期元素,B是短周期中金属性最强的元素,C是地壳中含量最高的金属元素,D单质的晶体是良好的半导体材料,E的最外层电子数与内层电子数之比为3:5,A与E同族.
A、B、C、D、E、F是原子序数依次增大的短周期元素,B是短周期中金属性最强的元素,C是地壳中含量最高的金属元素,D单质的晶体是良好的半导体材料,E的最外层电子数与内层电子数之比为3:5,A与E同族.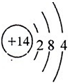
 .
. Al(OH)3﹢3H+,生氢氧化铝胶体,能吸附水中悬浮物,使之凝聚达到净水目的
Al(OH)3﹢3H+,生氢氧化铝胶体,能吸附水中悬浮物,使之凝聚达到净水目的查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:6:7 | B. | 1:1:1 | C. | 4:8:5 | D. | 8:4:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
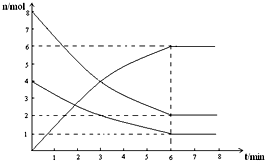 在673K、容积为2L的容器中发生下述反应,2SO2+O2?2SO3,开始时充入8molSO2和4molO2.测得各物质的物质的量随时间的变化曲线如图所示:
在673K、容积为2L的容器中发生下述反应,2SO2+O2?2SO3,开始时充入8molSO2和4molO2.测得各物质的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
 ,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.
,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑨ | ⑩ | ||
| 4 | ② | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com